お知らせ
2025年1月、順天堂大学大学院医学研究科腸内細菌療法リサーチセンターが発足しました。
本センターは、腸内細菌叢を標的とした新たな医療と創薬の確立を目指し、様々な研究施設や診療科と連携しながら、臨床と基礎研究を融合した先進的な研究拠点です。
Gut-Link Labホームページでは、腸内細菌叢移植療法に関する臨床研究や業績など、様々な情報を発信しております。是非ご覧ください。

順天堂大学大学院医学研究科腸内細菌療法リサーチセンター
Innovative Microbiome Resaerch Cetner
(Gut-Link Lab)
センター長
消化器内科 先任准教授 石川大
クローン病とは
クローン病は、潰瘍性大腸炎とともに炎症性腸疾患に分類される指定難病で、慢性あるいは寛解と再燃を繰り返す腸の炎症性疾患です。腸の一部に不規則に炎症が生じ、腸壁の深い層まで炎症が及ぶことや、腸に瘻孔が形成されることが特徴です。現時点で根本的な治療法はなく、再燃時や狭窄・瘻孔を伴う場合には外科的処置が必要となることもあり、患者の生活の質に大きな影響を与えます。日本においては、2019年時点で約4万人が医療受給者証を交付されており、国内でも患者数の多い指定難病です。
新しい「抗菌薬併用腸内細菌叢移植療法」の提唱
私たちはより効果的な腸内細菌叢の再構築と腸内細菌叢移植の効果増強を狙い、腸内細菌叢移植の前処置として3種類の抗菌薬を投与する「抗菌薬併用腸内細菌叢移植療法」 (図1)を提唱し、2014年6月から臨床研究を開始しました。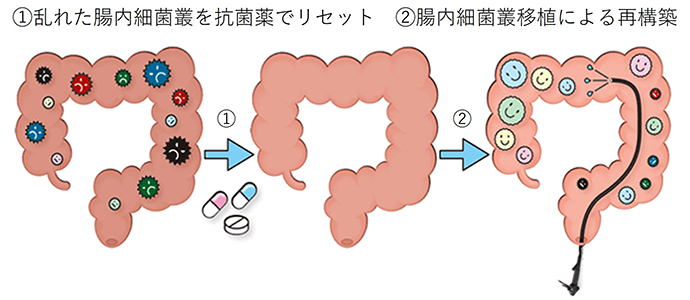
図1:抗菌薬併用腸内細菌叢移植療法の概念図
20歳以上の活動性のある潰瘍性大腸炎の患者さんを対象に行った本研究により、
①潰瘍性大腸炎に対する抗菌薬併用腸内細菌叢移植療法の短期、長期間有効性。
②腸内細菌のバクテロイデスが治療効果と潰瘍性大腸炎の病勢に関連すること。
③患者と便ドナーの関係が1.兄弟姉妹であること、2.年齢差が10歳以内(同世代)であることが腸内細菌叢移植の長期治療効果を高めること。
④抗菌薬併用腸内細菌叢移植療法による効果的な腸内細菌叢の再構築が、潰瘍性大腸炎の新たな治療法の確立につながる可能性。
が明らかになってきました。
本研究結果は、2017年11月、2018年12月に米国の学会誌「Inflammatory Bowel Disease」に掲載され(プレスリリース)、2020年5月に国際医学誌「Journal of Clinical Medicine」電子版で発表されました。(詳しくはプレスリリースからご覧になれます。)
治療を希望される患者さんへ
2025年9月より、新規の腸内細菌叢移植 臨床研究(活動期クローン病患者における抗菌薬併用腸内細菌叢移植療法(A-FMT)の臨床的有効性および安全性を評価する単施設単群試験)に参加する患者さんの募集を行っております。詳しくは外来を受診して頂き、お話しさせていただくことになります。対象者
16歳以上の活動性があり大腸に病変を有するクローン病の方
主治医が「活動性あり」と認めた方で、下記条件①~③を全て満たしている方が対象となります。なお、今までクローン病に対する治療を行ったことがない方、病状が現在落ち着いている方、重症の方は本臨床研究にはご参加いただけません。①主治医に当院での臨床研究参加の意思を伝えた上で、「診療情報提供書」の持参が可能である方
本臨床研究への参加中も基本的には主治医のもとで治療を継続していただき、主治医と当院とで連絡を取り合い、連携して進めていきます。
②定期的に受診が可能な方
初診、治療前検査(内視鏡検査あり)、腸内細菌叢移植1回、治療後検査(内視鏡検査あり)の合計4回受診していただくほか、適宜、便の提出をお願いしています。そのため外来受診が難しい方は、ご参加頂くことができません。なお、診察・治療等はすべて日帰りとなり、入院は必要ありません。
③抗菌薬を3ヶ月間服用していない方
腸内細菌叢移植の前処置として3種類の抗菌薬を内服するため、過去3ヶ月間抗菌薬を服用していない方を対象としています。
受診方法
受診時には「診療情報提供書」が必要となりますので、まずは主治医の先生とよくご相談ください。主治医の先生より参加の同意を得られましたら、患者さんからfmt@juntendo.ac.jpにメールでお問い合わせください。受診の手順や診察可能な日程などを調整致します。なお、患者さんからのお問い合わせは上記のメールでの対応となりますので、緊急の場合を除いて、お電話でのご連絡はご遠慮ください。
費用
本臨床研究のための薬剤や検査の費用は、順天堂大学の研究費負担となります。ただし、それ以外で使用する薬の費用や検査の費用は、通常の診療を受ける場合と同じように、健康保険を用いて自己負担分をお支払いいただくことになります。交通費や遠方よりお越しで宿泊を要した場合の費用は自己負担となりますので、予めご了承ください。
ご紹介いただく主治医の皆様へ
当科での腸内細菌叢移植の臨床研究が開始され約10年以上が経過し、症例数も増えてまいりました。現在までに得た治療効果や、腸内細菌叢と治療効果の関連などの知見については、国内外の学会、医学雑誌、論文にてご報告させていただいております。また、海外からの報告(Samuel. P et al.JAMA 2019) でも、潰瘍性大腸炎に対する腸内細菌叢移植のランダム化比較試験でFMTの治療効果が明らかになったことが報告され、更に注目が集まっています。未だ解明できていない領域の治療とは思いますが、腸内細菌叢移植については大きな可能性があるものと思っております。我々はステロイドやバイオ製剤の導入前の症例で治療効果が出ることを報告(2022年04月日本消化器病学会、2022年12月アメリカ炎症性腸疾患学会)しておりますので、薬剤治療に抵抗感がある、または薬剤アレルギーなどで薬物療法が使用しづらいIBD患者さんにはよい適応と思います。今回の臨床研究では以下の参加基準を設けておりますので、先生のご判断のもとに、情報提供書持参でご紹介頂ければ幸いです。外来日程については患者さん御自身でこちらにメール連絡して決めて頂ければと存じます。不明な点がございましたら、遠慮なくご連絡ください。
問い合わせ先:順天堂大学消化器内科 腸内細菌研究グループ fmt@juntendo.ac.jp
<患者さん参加基準>
下記の選択基準を全て満たし、かつ除外基準のいずれにも該当しない方【選択基準】
- 活動性を有し大腸に病変を有するクローン病患者
- 適格性確認日前日におけるHBIが7点以上の患者
- 適格性確認日において、クローン病の診断から12週以上経過している患者
- 同意取得時の年齢が16歳以上
- 外来・入院:外来通院中の患者のみ
- 同意能力を有しており、本人の自由意思により文書同意の取得が可能な患者。なお、患者
の同意取得年齢が18歳未満の場合、代諾者からの同意も文書で得られる患者。
【除外基準】
1.本研究で使用する薬剤に対して重篤なアレルギーを有する患者2.下記の薬物療法又は処置を、下記に示す期間内に実施した患者
- クローン病治療目的の抗菌薬:適格性確認前3ヶ月間
- 整腸剤:適格性確認日前1週間
4.臨床的に感染性腸炎の合併が疑われる患者
5.結核性疾患の患者
6.門脈圧亢進症の兆候を有する肝硬変(末期の原発性胆汁性肝硬変など)の患者
7.有効な抗菌薬の存在しない感染症、深在性真菌症の患者
8.重篤な心疾患を有する患者
9.腎障害(血清クレアチニンが2.0mg/dL以上、あるいはBUNが25mg/dL以上を示す)を有する患者
10.肝障害(総ビリルビンが3.0mg/dL以上又はAST(GOT)もしくはALT(GPT)※が100IU/L以上を示す)を有する患者
11.悪性腫瘍を有する又は治療後5年経過していない患者
12.明らかな精神症状を有する患者(治療の有無にかかわらず「医薬品の副作用の重篤度分類基準について」(平成4年6月29日、薬案第80号)グレード2以上に相当する状態)
13.薬物依存、アルコール依存の既往又は合併症を有する患者
14.妊婦、授乳婦、妊娠している可能性のある女性、同意取得時から治療期間中に妊娠を希望する女性及び適切な方法での避妊(子宮内避妊用具、ペッサリー又はパートナーのコンドーム使用遵守:ただし、経口避妊薬は使用禁止)に合意できない女性
15.同意取得時に追跡調査を含む他の臨床研究や治験に参加している患者
16.本研究実施計画書に定められた検査・観察等の実施前12週間以内に他の治験薬を投与 していた患者、もしくは他の臨床試験に参加していた患者、被験薬を投与していた患者
17.その他、研究責任(分担)医師が研究対象者として不適当と判断した患者
便提供者(ドナー)について
対象となる便提供者(ドナー)の方
18歳以上の健康な方
健康状態や既往歴、生活歴、抗菌薬の内服歴を問診させていただきます。提出していただいたドナー便は冷凍保存され、患者さんに投与されます。医師が健康状態に問題がないと判断したドナー候補の方についてはさらに
①採血検査
種々の感染症のチェックを検査いたします。
②便検査
便中にいるウイルスや感染症を引き起こすような細菌、寄生虫のチェックをいたします。
③唾液検査
新型コロナウイルスのチェックをいたします。
これら検査で異常を認めない場合、便を提供していただきます。
ドナー希望の方はこちらの応募フォームにて必要事項を入力してください。内容確認の上、こちらからお返事いたします。
腸内細菌研究グループより
今まで約240名の潰瘍性大腸炎の患者さん、約200名のドナーの皆さまにご参加いただきました。多くの方々のご協力を得るなかで、実際に患者さんの症状が改善していることを実感しており、先進医療B「活動期潰瘍性大腸炎患者を対象とする抗菌薬併用腸内細菌叢移植療法」など、これまで数多くの臨床研究を実施してまいりました。そして近い将来、通常治療としてより多くの患者さんに提供できることを目指して、今後も真摯に臨床研究を進めてまいります。その先には多くのクローン病や潰瘍性大腸炎の患者さんのより明るい人生に寄与できればと思っております。順天堂消化器内科 先任准教授 石川大
プレスリリース
- 2025.09.29
寛解導入率45.9%を達成 ―潰瘍性大腸炎に対する腸内細菌叢移植療法 ― 先進医療B研究で有効性と安全性を確認 ― - 2025.04.30
潰瘍性大腸炎に対する腸内細菌移植療法 “良いドナーの条件”と“ドナーと患者の相性”を解明 - 2024.10.21
順天堂大学とメタジェンセラピューティクス、 パーキンソン病患者に対する「腸内細菌叢移植療法」に関する共同研究を開始 - 2024.08.09
食道がん・胃がん患者さんを対象とした 「腸内細菌叢移植」の臨床試験を開始 - 2023.04.19
潰瘍性大腸炎を対象とした「抗菌薬併用腸内細菌叢移植療法」先進医療第1例目となる腸内細菌叢移植を実施 - 2023.01.04
潰瘍性大腸炎を対象とした「抗菌薬併用腸内細菌叢移植療法」が先進医療Bとして承認、2023年1月より実施 - 2022.04.12
順天堂大学とメタジェンセラピューティクスが共同研究講座「細菌叢再生学講座」を開設 - 2021.12.03
順天堂大学がAMED「次世代治療・診断実現のための創薬基盤技術開発事業(腸内マイクロバイオーム制御による次世代創薬技術の開発)」に採択 - 2020.08.07
潰瘍性大腸炎の新たな病態メカニズムを解明~ IL-26を産生する免疫CD8 T細胞の発見 ~ - 2020.06.25
兄弟、同世代のドナーが便移植療法の長期治療効果を高める~ 個別化腸内細菌療法の確立に向けて ~ - 2020.03.03
キリンと順天堂大学が「腸内細菌療法に関する共同研究」を開始~アレルギー疾患の新たな予防・治療方法開発を目指す~ - 2016.12.01
世界初!潰瘍性大腸炎に対する抗生剤併用便移植療法の有効性を確認~新たな腸内細菌療法の展開へ ~
-
腸内細菌療法の臨床研究についての主なマスメディア掲載情報
-
- 時事メディカル(2024.6)
他人の便を移植して治療―潰瘍性大腸炎ドナーの募集スタート - 毎日新聞(2024.6)
健康な人の腸内細菌を保管・治療に活用 「バンク」の運用始まる - 読売新聞(2024.4)
順大発企業「腸内細菌バンク」開始、専用サイトで協力者募る…「献便施設」で健康のお裾分けに協力を - Forbes Japan
Web-News(2024.4)
献「便」で難病患者に光 日本初「腸内細菌叢バンク」 - 講談社(2024.3)
大人も知らない 科学のふしぎ 「ののちゃんのDO科学」でサイエンスが好きになる - QLife・IBDプラス(2023.10~連載)
知れば納得!腸内細菌Q&A - NHK(2023.10)
漫画家イエナガの複雑社会を超定義「人間を操る〜!?腸内細菌で人生変わっちゃう?」 - NHK Eテレ(2023.4)
ヴィランの言い分「ウンチ」 - 日本経済新聞(2023.4)
うんちビジネス動き出す 順大は「大腸炎治療に効果」 - QLife・IBDプラス(2023.3)
腸内細菌の専門家に聞いた!「良い腸内環境」ってどういうこと? - 日本経済新聞(2023.2)
潰瘍性大腸炎、腸内細菌で治療 先進医療がスタート - 読売新聞(2023.1)
順天堂大、難病「潰瘍性大腸炎」の新治療法...健康な腸内細菌を移植 - Tarzan(2022.9)
北斎は腸活してた?「9人の専門家に聞いた、腸の面白トピックス」 - NHK(2022.6)
クローズアップ現代 「腸内細菌の知られざる力 体質改善からがん治療まで最新情報!」 - 読売新聞(2024.11)
子どもが目を輝かせる「茶色いダイヤ」…長寿や運動能力に関係と熱い視線 - Tarzan(2021.9)
腸のチカラ「腸の超スゴい話。」 - NHK
BSプレミアム(2021.7)
ヒューマニエンス~40億年のたくらみ「"腸内細菌"ヒトを飛躍させる生命体」 - NHK(2021.6)
ニュース シブ5時 「潰瘍性大腸炎」 - 朝日新聞Reライフ.net (2020.2)
健康な人の便を移植? 研究進む意外な治療法が目指すもの - NHK(2019.11)
所さん!大変ですよ「大ブーム!?なぞの"腸活"」 - NHK Eテレ(2019.9)
又吉直樹のヘウレーカ!「"茶色い宝石"ってどういうこと!?」 - Tarzan(2019.8)
新しい未来が待っている!日進月歩の腸内細菌トピックス。「腸トレ。」 - 日経メディカル(2018.3)
日経メディカルオンライン「潰瘍性大腸炎に抗菌薬併用便移植療法が有効」 - TBSラジオFM (2017.5)
腸から始まる健康ライフ「潰瘍性大腸炎の治療法とは?」 - TBS (2016.1)
テレビ未来遺産「池上彰と考える「伝染する病」(腸内フローラは難病治療に新たな光を与える?) - 朝日放送 (2016.1)
たけしの健康エンターテイメント!みんなの家庭の医学「潰瘍性大腸炎の「糞便移植療法」の紹介」 - 日経ヘルス (2015.12)
潰瘍性大腸炎に期待の治療法 健常者の便を移植 - 日本テレビ (2015.12)
スッキリ!!「上重聡の週刊からだニュース(腸内フローラについて)」 - TBS (2015.7)
健康カプセル!ゲンキの時間「糞便移植治療について」 - BSフジ (2015.7)
華大の知りたい!サタデー「腸内フローラについて」 - フジテレビ (2015.4)
とくダネ!医療プロジェクト「日本医療の最前線-腸内細菌移植療法について」 - 日本テレビ (2015.3)
心の絆!旅立ちスペシャル「輝く明日のために」 - NHK (2014.12)
ためしてガッテン「まさかの異変が!お酒の落とし穴 新事実」
- 時事メディカル(2024.6)
共同研究
腸内細菌叢の多角的解析、腸内細菌叢移植した腸内細菌の定着メカニズムなど、積極的に他施設との共同研究をすすめています。- 2024年8月より「国立研究開発法人国立がん研究センターおよびメタジェンセラピューティクス(株)」との共同研究が開始しました(詳しくはこちら)
- 2022年4月よりメタジェンセラピューティクス(株) と共同研究講座が設立されました。(詳しくはこちら)
- 2021年6月よりメタジェンセラピューティクス(株)との共同研究を開始しました。
- 2020年9月より慶応大学薬学部の金 倫基教授との共同研究を開始しました。
- 2019年12月よりキリンホールディングス(株)と共同研究講座が設立されました。(詳しくはこちら)
- 2017年4月よりアメリカ、ミシガン大学消化器内科の腸内細菌チームとの共同研究も開始されました。
- 2016年12月より「協和キリン(株)および協和発酵バイオ(株)」との共同研究が開始しました
研究成果
主な論文
- Ishikawa D, Watanabe H, Nomura K, Zhang X, Maruyama T, Odakura R, Koma M, Shibuya T, Osada T, Fukuda S, Nakahara T, Terauchi J, Nagahara A, Yamada T. Patient-donor similarity and donor-derived species contribute to the outcome of fecal microbiota transplantation for ulcerative colitis. J Crohns Colitis. 2025 Apr 4;19(4):jjaf054. https://doi.org/10.1093/ecco-jcc/jjaf054
- Ishikawa D, Zhang X, Nomura K, Shibuya T, Hojo M, Yamashita M, Koizumi S, Yamazaki F, Iwamoto S, Saito M, Kunigo K, Nakano R, Honma N, Urakawa I, Nagahara A. Anti-inflammatory effects of Bacteroidota strains derived from outstanding donors of fecal microbiota transplantation for the treatment of ulcerative colitis. Inflammatory Bowel Disease. 2024 May 11:izae080.
- Nagai M, Moriyama M, Ishii C, Mori H, Watanabe H, Nakahara T, Yamada T, Ishikawa D, et al. High body temperature increases gut microbiota-dependent host resistance to influenza A virus and SARS-CoV-2 infection. Nat Commun. 2023 Jun 30;14(1):3863.
- X Zhang, D Ishikawa, et al. Hot topics on fecal microbiota transplantation for the treatment of inflammatory bowel disease. Front Med (Lausanne). 2022 Dec 2.
- X Zhang, D Ishikawa, et al. Donor Screening Revisions of Fecal Microbiota Transplantation in Patients with Ulcerative Colitis. J. Clin. Med. 2022 February; 11(4), 1055
- D Ishikawa, et al. A Randomized Placebo-Controlled Trial of Combination Therapy With Post-triple-antibiotic-therapy Fecal Microbiota Transplantation and Alginate for Ulcerative Colitis: Protocol. Front. Med. 2022 February 22.
- K Nomura, D Ishikawa, et al. Bacteroidetes Species Are Correlated with Disease Activity in Ulcerative Colitis. J Clin Med. 2021 April 17;10:1749.
- Corridoni D, Antanaviciute A, Gupta T, Fawkner-Corbett D, Aulicino A, Jagielowicz M, Parikh K, Repapi E, Taylor S, Ishikawa D, et al. Single-cell atlas of colonic CD8+ T cells in ulcerative colitis. Nat Med. 2020 Sep;26(9):1480-1490.
- Koki Okahara, Dai Ishikawa,et al. Matching between Donors and Ulcerative ColitisPatients Is Important for Long-Term Maintenanceafter Fecal Microbiota Transplantation. Clin Med. 2020 May 31;9(6):1650.
- Takahashi M, Ishikawa D, et al. freezing preservation period influences colonization ability for faecal microbiota transplantation.J Appl Microbiol. 2019 Mar;126(3):973-984.
- Ishikawa D, et al. The Microbial Composition of Bacteroidetes Species in Ulcerative Colitis Is Effectively Improved by Combination Therapy with Fecal Microbiota Transplantation and Antibiotics Inflamm Bowel Dis. 2018 Aug.
- 石川 大、岡原昂輝、永原章仁「総説:便移植の現状と展望」腸内細菌学雑誌 2018 Jul 32:137-144
- Ishikawa D. Fecal Microbiota Transplantation for the Treatment of Gastrointestinal Disease: Present and Future Prospects Gastroenterological Endoscopy.2018 Apr ;60(4):969-980
- Ishikawa D, et al. Changes in Intestinal Microbiota Following Combination Therapy with Fecal Microbial Transplantation and Antibiotics for Ulcerative Colitis. Inflamm Bowel Dis. 2017 Jan ;23(1):116-125.
講演
- 「腸内微生物の研究と臨床応用」第33回日本小児リウマチ学会総会・学術集会(2024.10)
- 「腸内細菌療法の現状と展望」日本消化器病学会関東支部 第42回教育講演会(2024.6)
- 「潰瘍性大腸炎患者に対する抗菌剤併用便移植療法」第40回日本臨床薬理学会学術総会(2019.12)
- 「潰瘍性大腸炎患者に対する抗菌剤併用便移植療法のドナー選択の重要性」第10回日本炎症性腸疾患学会学術集会参加(2019.11)
- 「潰瘍性大腸炎患者に対する抗菌剤併用便移植療法の長期治療評価と腸内細菌叢変化の検討」第61回日本消化器病学会大会(2019.11)
- 「難病に対する腸内細菌療法~腸内フローラの宇宙の解明を目指して~」第41回日本臨床栄養学会総会(2019.10)
- 「消化器疾患に対する便移植療法~胃酸分泌抑制剤と腸内フローラの関連を含めて~」Next Symposium 2019 in Sapporo(2019.10)
- 「潰瘍性大腸炎に対する抗菌剤併用便移植療法~治療効果と関連する腸内細菌の解析~」第113回日本消化器内視鏡学会北陸支部例会(2019.6)
- 「最先端治療セミナー『腸内細菌叢(便移植)と免疫』」免疫細胞治療セミナー2019(2019.6)
- 「消化器疾患に対する便移植療法~胃酸分泌抑制剤と腸内フローラの関連を含めて~」第42回日本肝臓学会東部会(2018.12)
- 「腸内フローラ:難病治療との関係」第四回 医療連携講演会(2018.09)
- 「国際交流:腸内細菌の重要性と抗生剤の使用方法」ベトナム、サンライズホスピタル設立記念講演(2018.09)
- 「腸内細菌と腸疾患の関わり」第21回日本適応医学会(2017.12)
- 「Clostridium difficile 感染性腸炎と潰瘍性大腸炎に対する便移植療法」第66回日本感染症学会東日本地方会学術集会(2017.11)
- 「潰瘍性大腸炎に対する便移植療法」第27回九州内視鏡下外科手術研究会(2017.09)
- "Comprehensive Bacteriotherapy: Combination with Fecal Microbial Transplantation and Antibiotics for Ulcerative Colitis" 国際セッション 第103回日本消化器病学会総会(2017.04)
- 「腸内細菌をデザインする~便移植療法とは~」第39回日本分子生物学会年会 (2016.12)
- 「潰瘍性大腸炎に対する抗菌剤併用便移植療法」第20回腸内細菌学会(2016.06)
- 「潰瘍性大腸炎に対する腸内細菌療法の有効性の検討」第2回 Gut Microbiota学会(2016.04)
受賞
- 第51回日本潰瘍学会 準学術奨励賞
(2024.3)
GI Bioregulationカンファレンス Nice Young Investigator賞(2022.1) - 第48回日本潰瘍学会 学術奨励賞(2021.3)
- 15th Congress of ECCO 2020 "Top Ten Best DOPs" (2020.2)
- 2017年学術誌Journal IBD 高引用優秀論文賞 (2019.04)
- 日本炎症性腸疾患学会 優秀演題賞(2018.11)
- "The Microbial Composition in Ulcerative Colitis is Effectively Improved by Combination of FMT and Multiple Antibiotic Therapy"第6回アジア腸疾患学会 Best abstract賞 (2018.07)
- アメリカ消化器病学会週間 DDW2017 当科FMT研究に関する特集TV (2017.05)