- 順天堂大学医学部附属順天堂医院
- 診療科・部門
- 診療科・外来部門
- 呼吸器内科
- 研究・学会活動
- 研究・学会活動
研究・学会活動
TOPICS
kokyukinaika_t
順天堂大学呼吸器内科 研究紹介動画
研究テーマ

呼吸器疾患の研究は、多岐にわたっており、その研究対象は豊富です。現在、当講座で行っている研究プロジェクトは以下に分かれており、それぞれ精力的に活動しています。また最新の知識や技術を導入するために国立がん研究センター、癌研有明病院基礎研究部、理化学研究所や順天堂大学医学部基礎研究講座との共同研究も積極的に行っています。世界的なCOVID-19感染拡大により、現在は難しい状況ですが、ハーバード大学医学部、オハイオ州立大学、ミシガン大学など複数の施設への海外留学も積極的に推奨しています。そして基礎研究で得られた知識と技術を臨床医学に応用し、難治性呼吸器疾患の予防・診断・治療に寄与すること、そして医学の発展に貢献することを目標としています。
全て開く
- 肺腫瘍グループ(肺癌・中皮種・胸腺腫瘍)基礎研究
-
肺腫瘍グループ基礎研究
EGFR-TKI耐性メカニズムの解析
癌幹細胞は抗癌剤や分子標的治療薬に対する抵抗性が高く、近年、この癌幹細胞を治療標的とする新たな戦略の重要性が示唆されています。現在までに研究代表者である高橋史行らは、Harvard Medical School/MGH Cancer Centerとの共同研究でEGFR-TKI高感受性肺癌細胞株を高濃度のGefitinibで培養し、薬剤抵抗性を示し残存した細胞集団は癌幹細胞マーカーCD133が陽性で、そのほとんどは静止期に維持していることを報告しました(論文1)。また、この細胞集団をGefitinib-Resistant Persisters (GRPs)と名付け、GRPsは極めて幹細胞性の高い細胞集団であることを報告し(論文2, 3)、その静止期維持機構にFBXW7遺伝子が寄与していることも見出しています(論文4)。そして上皮間葉転換(Epithelial mesenchymal transition; EMT)と癌幹細胞性についても研究していますが、EMT誘導因子であるZEB-1遺伝子がmiR200cおよびBMI1遺伝子との相互作用を通してEGFR-TKI耐性に寄与していることも報告しました(論文5、Figure)。現在、EGFR遺伝子変異肺癌のFirst lineとなっている第三世代EGFR-TKIであるOsimertinib耐性についても、当研究グループでは複数のOsimertinib耐性細胞株を樹立しており、Whole exomeシークエンスやKinase arrayを用いて解析し、また患者腫瘍生検組織の解析によりIGF1R(Insulin-like growth factor-1 receptor)活性化がOsimertinib耐性に寄与している可能性を見出し、報告しています (論文6)。また国立がん研究センターの間野博行先生、高阪真路先生との共同研究で、肺癌臨床検体を用いて病的意義の不明なEGFR遺伝子バリアントのハイスループット機能解析も行い、幾つかのEGFR-TKI耐性に関わる重複変異Compound mutationも報告しています(論文7)。
Overexpression of ZEB1 increased sphere and CD133+ Gefitinib-Resistant Persisters (GRPs)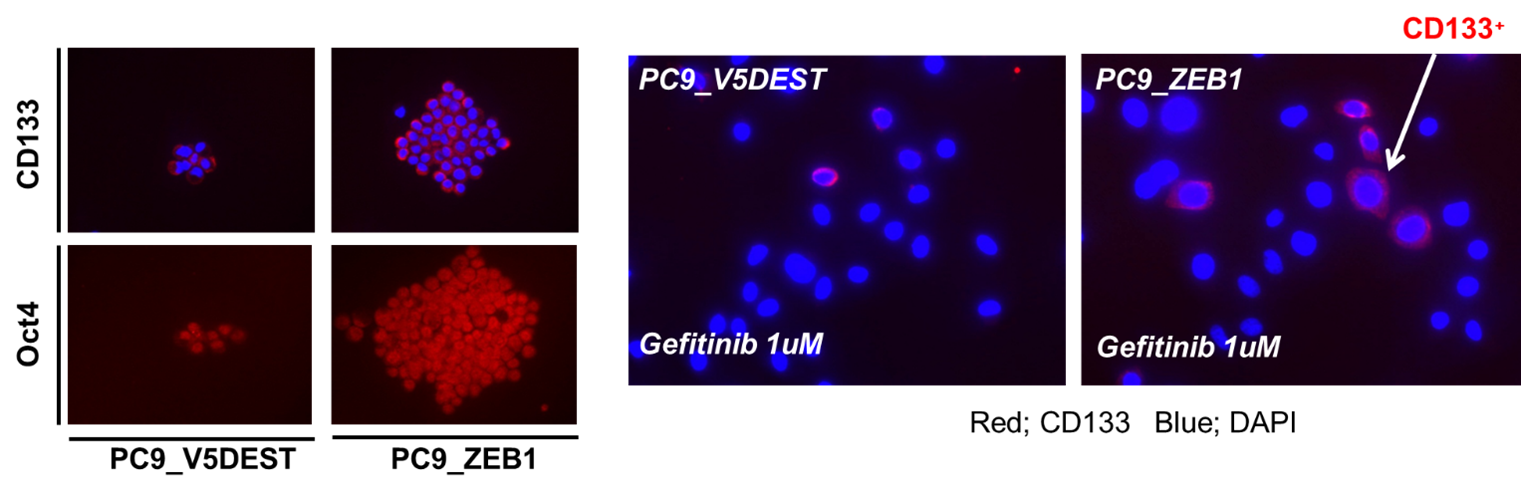
発表論文
- Sharma SV, Lee DY, Li B, Quinlan MP, Takahashi F, Maheswaran S, McDermott U, Azizian N, Zou L, Fischbach MA, Wong KK, Brandstetter K, Wittner B, Ramaswamy S, Classon M, Settleman J. A chromatin-mediated reversible drug-tolerant state in cancer cell subpopulations. Cell 141:69-80. (2010)
- Murakami A, Takahashi F, Tajima K, Takahashi K, et al. Hypoxia increases gefitinib-resistant lung cancer stem cells through the activation of insulin-like growth factor 1 receptor. PLoS One 28;9:e86459 (2014)
- Kobayashi I, Takahashi F, Tajima K, Takahashi K, et al. Oct4 plays a crucial role in the maintenance of gefitinib-resistant lung cancer stem cells. Biochem Biophys Res Commun. 22;473:125-32. (2016)
- Hidayat M, Mitsuishi Y, Takahashi F, Takahashi K. et al. Role of FBXW7 in the quiescence of gefitinib-resistant lung cancer stem cells in EGFR-mutant non-small cell lung cancer. BJBMS 19:355-367. (2019)
- Nurwydia F, Takahashi F, Tajima K, Mitsuishi Y, Takahashi K. et al. ZEB1 plays a crucial role in maintenance of lung cancer stem cells resistant to gefitinib. Thoracic Cancer 12:1536-1548. (2021)
- Hayakawa D, Takahashi F, Mitsuishi Y, Tajima K, Kohsaka S, Mano H, Takahashi K, et al. Activation of insulin-like growth factor-1 receptor confers acquired resistance to osimertinib in non-small cell lung cancer with EGFR T790M mutation. Thoracic Cancer 11:140-149. (2020)
- Kohsaka S, Nagano M, Ueno T, Suehara Y, Hayashi T, Shimada N, Takahashi K, Suzuki K, Takamochi K, Takahashi F, Mano H. A method of high-throughput functional evaluation of EGFR gene variants of unknown significance in cancer. Science Transl Med 15;9. (2017)
エピジェネティクスを標的とした新たな治療標的の模索(中皮腫・小細胞肺がん)
【中皮腫】中皮腫ならびに小細胞肺がんは極めて予後不良の悪性腫瘍であり、有効な分子標的治療薬や免疫療法の開発には至っておらず、生存期間の延長には新規の治療法の確立が急務です。現在までに研究代表者である田島健は、愛知県立がんセンターとの共同研究で、中皮腫におけるCD44のvariant isoformが抗がん剤耐性に関与している事を示しており(論文1)、また当グループの八戸敏史は慶応大学との共同研究によりCD44のvariant isoformの発現にエピジェネティクス、特にヒストンのメチル化が関与している事を明らかにしてきました(論文2)。さらに田島健はMassachusetts General Hospital Cancer Centerとの共同研究でヒストンメチル化酵素が治療標的になり得る可能性が高い事を報告しています(論文3)。
中皮腫においてエピジェネティクス、特にヒストンメチル化に焦点をあて、新たな治療戦略を研究しています。現在までにヒストン脱メチル化酵素が中皮腫において間葉系の遺伝子発現を制御していることを明らかにし、さらにこのヒストン脱メチル化酵素の抑制が殺細胞性抗がん剤の感受性を高めることを見出し、ヒストン修飾と上皮間葉転換を標的とした新規治療法の可能性を示した研究がMol Cancer Res誌に採択され、さらにこの論文はEditors Pickに選出されhigh lightとして巻頭を飾った(論文6)。これらの経験より、シングルセル解析により新規治療標的の同定を試みる新たなプロジェクトも開始しています(競争的資金4)。
【小細胞肺がん】
小細胞肺がんにおいても同様にエピジェネティクスに焦点をあて、ヒストン脱メチル化酵素のvariant isoformが治療標的になり得る事を報告しています(論文4)。また新たな知見として、ヒストンメチル化酵素であるSETD1Aの発現を抑制することにより、がん細胞において細胞老化が誘導されること明らかにし(論文5)、ヒストンメチル化酵素を標的とする新規治療法の開発をさらに大きく発展させ、今後新たな治療法としてなり得るか研究を継続しています。さらに小細胞肺がんにおいて、腫瘍抑制遺伝子の変異が多く報告されていることに着目し、腫瘍抑制遺伝子を標的とした新たな治療標的ならびに治療法を探索しています(競争的資金5)。胸部悪性腫瘍における腫瘍内不均一性の解明と薬剤耐性克服
抗がん剤耐性は悪性腫瘍の根治を阻む最大の難題かつ障壁です。悪性腫瘍では、腫瘍内不均一性が形成され、この不均一性こそ薬剤耐性の根本的な原因として考えられています。シングルセルマルチオミクス解析により腫瘍内不均一性のメカニズムの解明、薬剤耐性回避や解除、新たな創薬の標的同定と革新的な治療薬の創出を目指しています(競争的資金1、3)。胸部悪性腫瘍における細胞老化を標的とした新規治療法の開発
近年、細胞老化はアポトーシスに匹敵する抗腫瘍効果を持つことが示されたが、田島健はMassachusetts General Hospital Cancer Centerとの共同研究でエピジェネティクス、特にヒストンメチル化を変化させることにより細胞老化が誘導されることを明らかにしました(論文5)。現在この細胞老化を標的とすることが新規の治療法としてなり得るか検証しています。(競争的資金2)
発表論文
- Tajima K, Ohashi R, Sekido Y, Hida T, Nara T, Hashimoto M, Iwakami S, Minakata K, Yae T, Takahashi F, Saya H, and Takahashi K. Osteopontin-mediated enhanced hyaluronan binding induces multidrug resistance in mesothelioma cells. Oncogene 29, 1941-51 (2010).
- Yae T, Tsuchihashi K, Ishimoto T, Motohara T, Yoshikawa M, Yoshida GJ, Wada T, Masuko T, Mogushi K, Tanaka H, Osawa T, Kanki Y, Minami T, Aburatani H, Ohmura M, Kubo A, Suematsu M, Takahashi K, Saya H, Nagano O. Alternative splicing of CD44 mRNA by ESRP1 enhances lung colonization of metastatic cancer cell. Nature Commun. 3:883. (2012)
- Tajima K, Yae T, Javaid S, Tam O, Comaills V, Wittner B, Morris R, Liu M, Engstrom A, Takahashi F, Black J, Ramaswamy S, Shioda T, Hammell M, Haber DA, Whetstine JR, Maheswaran S. SETD1A modulates cell cycle progression through a miRNA network that regulates p53 target genes. Nat Commun 6, 8257 (2015).
- Johtatsu T, Tajima K, Yagishita S, Takahashi F, Takahashi K, et al. LSD1/KDM1 isoform LSD1+8a contributes to neural differentiation in small cell lung cancer. Biochemistry and Biophysics Reports (2017).
- Tajima, K., Matsuda, S., Yae, T., Drapkin, B. J., Morris, R., Boukhali, M., Niederhoffer, K., Comaills, V., Dubash, T., Nieman, L., Guo, H., Magnus, N. K. C., Dyson, N., Shioda, T., Haas, W., Haber, D. A., and Maheswaran, S. SETD1A protects from senescence through regulation of the mitotic gene expression program. Nature Commun. 10, 2854 (2019)
- Wirawan, A., Tajima, K., Takahashi, F., Mitsuishi, Y., Winardi, W., Hidayat, M., Hayakawa, D., Matsumoto, N., Izumi, K., Asao, T., Ko, R., Shimada, N., Takamochi, K., Suzuki, K., Abe, M., Hino, O., Sekido, Y., and Takahashi, K. A Novel Therapeutic Strategy Targeting the Mesenchymal Phenotype of Malignant Pleural Mesothelioma by Suppressing LSD1. Mol Cancer Res. 20, 127-138 (2022)
競争的資金
- 国立研究開発法人科学技術振興機構・創発的研究支援事業研究 研究代表者 (23718873)
「可逆性分化モデルによる腫瘍内不均一性の解明と薬剤耐性克服」 - 日本学術振興会 科学研究費助成事業 挑戦的研究(萌芽) 研究代表者 (23K18438)
「エピジェネティクスの再構成の追跡による老化細胞の分類構築と新規治療法開発への挑戦」 - 日本学術振興会 科学研究費助成事業 基盤研究(B) 研究代表者 (23H02774)
「薬剤耐性クローンに着目した腫瘍内不均一性と薬剤耐性原理の解明」 - 日本学術振興会 科学研究費助成事業 基盤研究(B) 研究分担者 (21H02927)
「中皮腫における細胞系譜構築による新規治療法の探究と臨床応用」 - 日本学術振興会 科学研究費助成事業 基盤研究(B) 研究代表者 (20H03535)
「ユビキチン化を標的とした細胞死と細胞老化誘導による小細胞肺がん新規治療法の探索」
Tyrosine kinase遺伝子異常の網羅的探索システムを用いた新規がん分子標的治療法の開発
近年、非小細胞肺癌をはじめとした複数の癌腫において、ゲノム網羅的な遺伝子解析により治療標的となる遺伝子異常が同定され、中でもチロシンキナーゼ(Tyrosine kinase; TK)遺伝子異常は、非小細胞肺癌患者の予後を飛躍的に改善させています。当科では、呼吸器外科、整形外科、人体病理学教室との共同研究により、非小細胞肺癌、小細胞肺癌、胸腺癌などの腫瘍組織検体を用いて、NanoStringシステム独自のmRNAベース・スクリーニング解析を行い、難治性疾患である胸部悪性腫瘍の治療標的になりうる新規チロシンキナーゼ(TK)遺伝子異常の同定および治療法の開発を目指しています。肺癌における酸化ストレス応答系の破綻機序の解明と治療標的の探索
近年の大規模な肺癌の包括的ゲノム解析により、多くドライバー遺伝子異常が同定されそれらを標的にした創薬が進められています。ドライバー遺伝子異常陽性例に対しては,それらを標的としたキナーゼ阻害薬の投与で予後が改善されることから、これらの阻害薬の投与機会を逸しないことが非常に重要になってきています。その一方で依然としてドライバー遺伝子異常が明らかではない、またはドライバー遺伝子異常があってもその標的に対する分子標的治療が開発途上にある症例も依然として多く存在しています。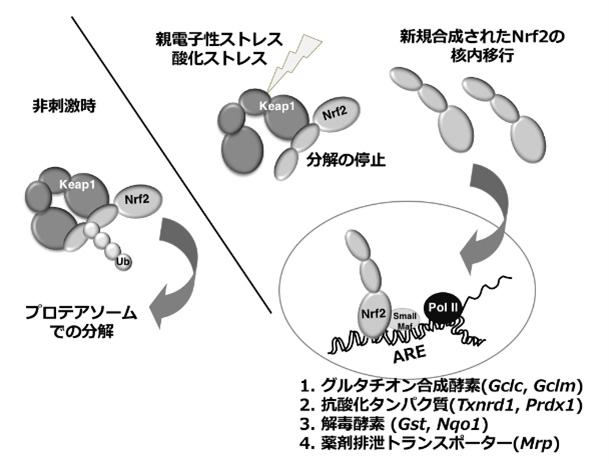
研究代表者の光石陽一郎は肺腺癌の22%、肺扁平上皮癌の34%と高頻度に体細胞変異を認める酸化ストレス応答経路KEAP1-NRF2経路に着目しています。この経路は転写因子NRF2、そのE3ユビキチンリガーゼ複合体であるKEAP1とCUL3で構成され、酸化ストレス存在下でKEAP1がそれを感知しNRF2を誘導的に安定化し、各種生体防御遺伝子群を活性化する生体防御システムです(左図参照)。光石はこの経路の研究で先駆的な業績をあげてきた東北大学の山本雅之研究室で大学院博士課程を過ごし、非小細胞肺癌におけるNRF2の機能解析をテーマに研究を進めて来ました。2015-2017年の3年間、米国ダナファーバー癌研究所とブロード研究所(Matthew Meyerson研究室)でのポスドク時代にこの経路の創薬プロジェクトに関わり、2017年10月に帰国後に引き続きこのKEAP1-NRF2経路の肺癌における破綻の意義と創薬の可能性をテーマに研究を開始しています。
また近年ではThe Cancer Genome Atlas (TCGA)プロジェクトをはじめとした大規模なシーケンス情報が公開され、それらを用いて肺癌の新しい病態を解明することに強い関心を持っています。2019年より順天堂医院で同意をいただいた肺癌患者様の検体を用いてシーケンス解析を開始し、当院の呼吸器外科学講座・人体病理病態学講座と連携しながら適宜拡大していく予定です。発表論文
- Inoue D, Suzuki T, Mitsuishi Y, Miki Y, Suzuki S, Sugawara S, Watanabe M, Sakurada A, Endo C, Uruno A, Sasano H, Nakagawa T, Satoh K, Tanaka N, Kubo H, Motohashi H, Yamamoto M. Accumulation of p62/SQSTM1 is associated with poor prognosis in patients with
lung adenocarcinoma.
Cancer Sci. 103(4):760-6 (2012) - Mitsuishi Y, Taguchi K, Kawatani Y, Shibata T, Nukiwa T, Aburatani H, Yamamoto M, Motohashi H. Nrf2 redirects glucose and glutamine into anabolic pathways in metabolic reprogramming.
Cancer Cell 10;22(1):66-79 (2012) - Mitsuishi Y, Motohashi H, Yamamoto M. The Keap1-Nrf2 system in cancers: stress response and anabolic metabolism. Front Oncol. 26;2:200 (2012)
- Zhang X, Choi PS, Francis JM, Gao GF, Campbell JD, Ramachandran A, Mitsuishi Y, Ha G, Shih J, Vazquez F, Tsherniak A, Taylor AM, Zhou J, Wu Z, Berger AC, Giannakis M, Hahn WC, Cherniack AD, Meyerson M. Somatic Superenhancer Duplications and Hotspot Mutations Lead to Oncogenic Activation of the KLF5 Transcription Factor. Cancer Discov. 2018 Jan;8(1):108-125.
- Kitajima S, Ivanova E, Guo S, Yoshida R, Campisi M, Sundararaman SK, Tange S, Mitsuishi Y, Thai TC, Masuda S, Piel BP, Sholl LM, Kirschmeier PT, Paweletz CP, Watanabe H, Yajima M, Barbie DA. Suppression of STING Associated with LKB1 Loss in KRAS-Driven Lung Cancer. Cancer Discov. 2019 Jan;9(1):34-45.
- Llabata P, Mitsuishi Y, Choi PS, Cai D, Francis JM, Torres-Diz M, Udeshi ND, Golomb L, Wu Z, Zhou J, Svinkina T, Aguilera-Jimenez E, Liu Y, Carr SA, Sanchez-Cespedes M, Meyerson M, Zhang X. Multi-Omics Analysis Identifies MGA as a Negative Regulator of the MYC Pathway in Lung Adenocarcinoma. Mol Cancer Res. 2020 Apr;18(4):574-584.
- Carrot-Zhang J, Soca-Chafre G, Patterson N, Thorner AR, Nag A, Watson J, Genovese G, Rodriguez J, Gelbard MK, Corrales-Rodriguez L, Mitsuishi Y, Ha G, Campbell JD, Oxnard GR, Arrieta O, Cardona AF, Gusev A, Meyerson M. Genetic Ancestry Contributes to Somatic Mutations in Lung Cancers from Admixed Latin American Populations. Cancer Discov. 2021 Mar;11(3):591-598.
肺癌における免疫チェックポイント阻害薬のバイオマーカー探索
近年、肺癌に対する免疫療法が目覚ましい発展を遂げています。しかし高い効果を認める症例を経験する一方で、まったく効果が得られない症例もあり、治療効果を予測するバイオマーカーの探索は急務です。免疫チェックポイント阻害薬の効果予測因子としてmicrosatellite instabilityの有用性も報告されていますが、肺癌においては厳しい状況です(論文1)。全エクソーム解析、トランスクリプトーム解析よりアミノ酸置換を引き起こす体細胞変異の同定と癌細胞における発現、また抗原提示にはHLAとの親和性が重要であり、HLAアレルの解析も必要です。CD8陽性T細胞、制御性T細胞、骨髄由来免疫抑制細胞、腫瘍会合性マクロファージ、樹状細胞は重要な因子であり、ほかにも様々なサイトカインが腫瘍微小環境において重要な役割を担っていると考えられます。現在、これらを網羅的に解析するために、東京医大医学総合研究所との共同研究により多重免疫染色での解析を実践しています(図参照)。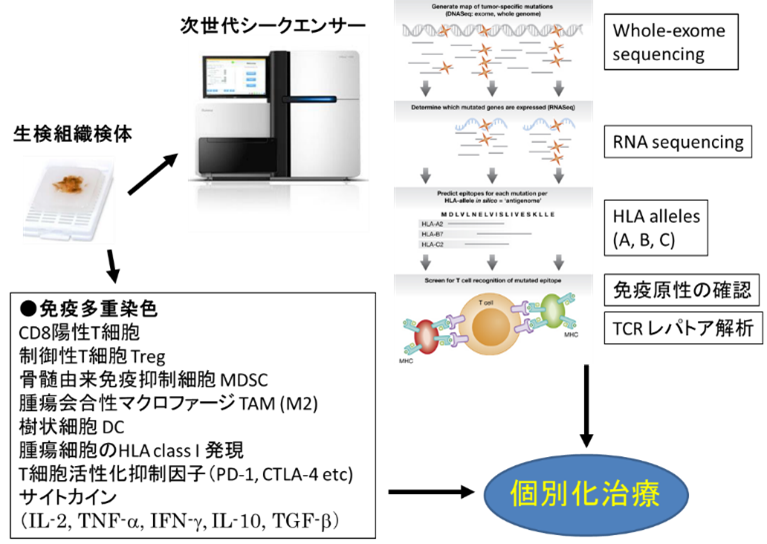
発表論文
- Takamochi K, Takahashi F, Suehara Y, Kitano S, Sato E, Kohsaka S, et al. DNA mismatch repair deficiency in surgically resected lung adenocarcinoma: Microsatellite instability analysis using the Promega panel Lung Cancer. Lung Cancer 110:26-31. (2017)
- 肺腫瘍グループ(肺癌・中皮種・胸腺腫瘍)臨床研究
-
肺がんグループ臨床研究
進行胸腺がんに対する化学療法についての研究
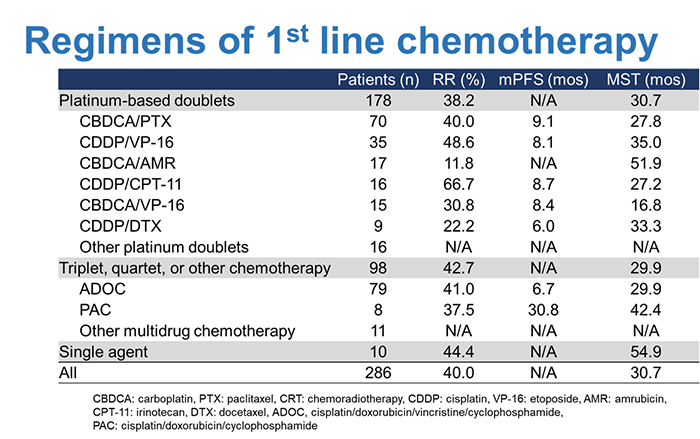
胸腺がんは非常にまれな疾患であるため、大規模な前向き臨床試験の実施が困難であり、標準治療が確立していない疾患です。特に進行例に対する化学療法については、データが極めて少なく、実臨床において治療選択に悩むことが多いのが実情です。そこで、当科を主体とし、NEJSG(北東日本研究機構)の協力のもと、進行胸腺がんに対する化学療法に関する、大規模な後ろ向き研究を実施しました。2016年のASCO(米国臨床腫瘍学会)で発表後、複数の研究成果を論文で報告しています(論文1-3)。この結果は、実臨床における治療選択にとって、貴重なデータになると考えられます。
発表論文
- Ko R, Shukuya T, Okuma Y, Tateishi K, Imai H, Iwasawa S, Miyauchi E, Fujiwara A, Sugiyama T, Azuma K, Muraki K, Yamasaki M, Tanaka H, Takashima Y, Soda S, Ishimoto O, Koyama N, Morita S, Kobayashi K, Nukiwa T, Takahashi K. Prognostic factors and efficacy of first-line chemotherapy in patients with advanced thymic carcinoma: a retrospective analysis of 286 patients from NEJ023 study. Oncologist 2018; 23(10): 1210-17.
- Tateishi K, Ko R, Shukuya T, Okuma Y, Watanabe S, Kuyama S, Murase K, Tsukita Y, Ashinuma H, Nakagawa T, Uematsu K, Nakao M, Mori Y, Kaira K, Mouri A, Miyabayashi T, Sakashita H, Matsumoto Y, Tanigawa T, Koizumi T, Morita S, Kobayashi K, Nukiwa T, Takahashi K. Clinical Outcomes of Second-Line Chemotherapy in Patients with Previously Treated Advanced Thymic Carcinoma: A Retrospective Analysis of 191 Patients from the NEJ023 Study. Oncologist. 2020 Apr;25(4):e668-e674.
- Okuma Y, Ko R, Shukuya T, Tateishi K, Imai H, Iwasawa S, Miyauchi E, Kojima T, Fujita Y, Hino T, Yamanda S, Suzuki T, Fukuizumi A, Sakakibara T, Harada T, Morita S, Kobayashi K, Nukiwa T, Takahashi K; North East Japan Study Group. Prognostic factors for patients with metastatic or recurrent thymic carcinoma receiving palliative-intent chemotherapy. Lung Cancer. 2020 Oct;148:122-128.
この研究データをふまえ、現在、我々の施設が中心となって、全国15施設で、「進行・再発胸腺癌に対するカルボプラチン+パクリタキセル+アテゾリズマブ(MPDL3280A)の第II相試験(医師主導治験)」を行っています。
未治療進行非小細胞肺がんにおける悪液質の前向き観察研究
がん悪液質は、通常の栄養サポートでは完全に回復することができない、体重減少や食欲不振を特徴とする症候群です。悪液質を合併している患者において、食欲不振をきたす化学療法は、より強く食欲不振を生じてしまう可能性があります。また、がん患者における体重減少は予後を悪化させるとされ、化学療法の治療効果にも影響を与える可能性がありますが、その実態は明らかではありません。そこで、NEJSG(北東日本研究機構)の協力のもと、当科を主体とした全国47施設により、化学療法が未施行で悪液質を合併している進行非小細胞肺がんに対し、食欲に関するQOLを評価する前向き観察研究を実施中です(UMIN ID: UMIN000041813)。がん悪液質の食欲不振に対する治療薬が2021年に国内承認されており、がん悪液質に対する早期介入の重要性が明らかとなりうる本研究は、今後のがん治療において有用なものとなると考えられます。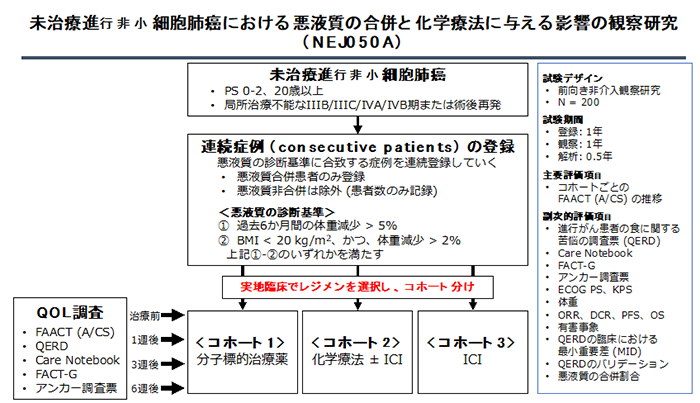
オリゴメタスターシスを伴う非小細胞肺がんに対する免疫チェックポイント阻害薬と局所治療を含む集学的治療の検討
オリゴメタスターシスは、乳がんや肺がんにおいて局所進行期と全身に広く転移した状態の中間の状態と考えられており、標準治療に局所治療(手術や放射線治療)を追加することで、生存期間の延長が得られる集団として、欧米を中心に治療開発が進められてきています。一方で、オリゴメタスターシスを伴う非小細胞肺がん患者さんに対して、主要な薬剤の一つとなっている免疫チェックポイント阻害薬と局所治療を組み合わせた集学的な治療の有効性や安全性は十分に明らかになっていません。そこで、当科および静岡がんセンターを中心として、西日本がん研究機構の18施設が参加して、オリゴメタスターシスを伴う非小細胞肺がん患者さんにおいて、現在の標準治療であるプラチナ製剤併用化学療法+ペムブロリズマブ(免疫チェックポイント阻害薬)に局所治療を追加することの有効性及び安全性を評価する単群第II相試験を実施中です(jRCTs041200046)。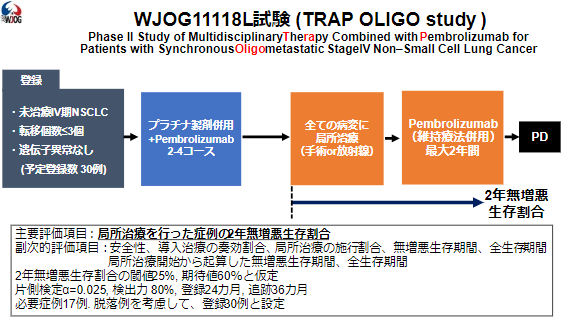
発表論文
- Miyawaki T, Kenmotsu H, Harada H, Ohde Y, Chiba Y, Haratani K, Okimoto T, Sakamoto T, Wakuda K, Ito K, Uemura T, Sakata S, Kogure Y, Nishimura Y, Nakagawa K, Yamamoto N. Phase II study of multidisciplinary therapy combined with pembrolizumab for patients with synchronous oligometastatic non-small cell lung cancer TRAP OLIGO study (WJOG11118L). BMC Cancer. 2021 Oct 18;21(1):1121. doi: 10.1186/s12885-021-08851-z.
既治療EGFR遺伝子変異陽性非扁平上皮非小細胞肺癌に対するカルボプラチン+ペメトレキセド+ペムブロリズマブ(MK-3475)+レンバチニブ(E7080/MK-7902)併用療法の第II相試験(NEJ052, 医師主導治験)
世界初のEGFRチロシンキナーゼ阻害薬(EGFR-TKI)であるゲフィチニブの登場から約20年経過し、第3世代EGFR-TKIの登場などにより、EGFR遺伝子変異陽性非小細胞肺癌患者さんに対するEGFR-TKIを用いた治療の成績は年々向上しています。しかし、EGFR-TKIが効かなくなってしまった患者さんに対する治療は、現在も20年前と変わらず、標準治療はプラチナ併用化学療法のままとなっています。そこで、EGFR-TKIが効かなくなった患者さんにおけるプラチナ併用化学療法に抗PD-1抗体(ペムブロリズマブ)と、マルチキナーゼ阻害薬(レンバチニブ)を組み合わせた治療の有効性を評価し、新たな標準治療の候補となり得るかを評価する医師主導治験を行っています(NCT05258279)。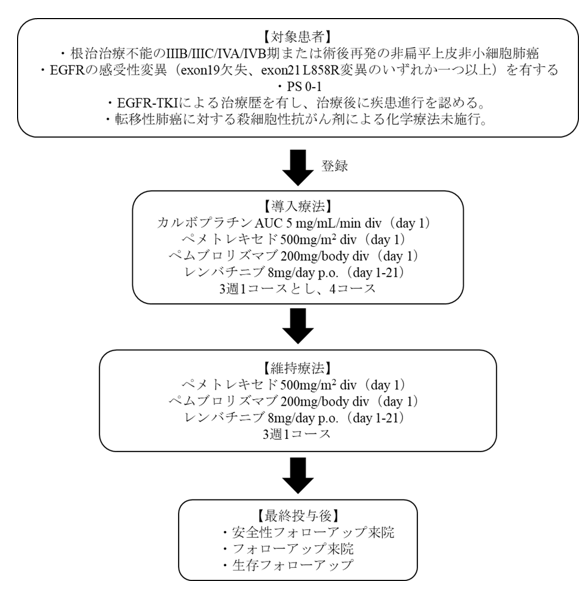
治験・臨床研究
当科主体の研究の他、本邦未承認薬の治験や、JCOG(日本臨床腫瘍研究グループ)、NEJ(北東日本研究機構)、WJOG(西日本がん研究機構)などの臨床研究グループが実施している臨床試験に、積極的に参加し、最先端の肺がん治療を実践しています(表1)。
表1.現在当科で実施中の治験・臨床試験の一例対象疾患 phase 試験治療 治験 PD-L1陽性非小細胞肺がん 3 抗PD-1抗体+抗TIGIT抗体 治験 PD-L1高発現の非小細胞肺がん 3 抗PD-1抗体+抗TROP2抗体 治験 EGFRエクソン20遺伝子変異非小細胞肺がん 3 抗EGFR/Met抗体+抗がん剤 治験 進行非小細胞肺がん 3 第3世代EGFR-TKI 治験 局所進行非小細胞肺がん 3 化学放射線療法+抗PD-1抗体+PARP阻害剤 治験 局所進行小細胞肺がん 3 化学放射線療法+抗PD-1抗体+PARP阻害剤 治験 進行小細胞肺がん 3 プラチナ併用化学療法+抗PD-1抗体+抗VEGF抗体 治験 既治療のc-MET陽性非小細胞肺がん 3 抗c-MET抗体 治験 RET融合遺伝子陽性非小細胞肺がん 3 RET阻害剤 治験 KRAS G12C陽性非小細胞肺がん 2 抗がん剤+KRAS阻害剤 治験 進行・再発胸腺癌 2 抗がん剤+抗PD-L1抗体 治験 抗PD-(L)1抗体+抗がん剤で病勢進行後の非小細胞肺がん 1 抗がん剤+抗VEGF抗体+抗PD-1抗体+EP4拮抗剤 臨床試験 Oligometastasisの非小細胞肺がん 2 プラチナ併用化学療法+局所療法 臨床試験 進行非小細胞肺がん(ドライバー変異なし) 3 抗がん剤+抗PD-1抗体、または、抗がん剤+抗PD-1抗体+抗CTLA-4抗体 臨床試験 EGFR遺伝子変異陽性進行非小細胞肺がん 3 第3世代EGFR-TKI、または、第2世代EGFR-TKI+抗VEGF抗体 臨床試験 EGFR uncommon 変異を有する進行非小細胞肺がん 3 プラチナ併用化学療法 または 第2世代EGFR-TKI 臨床試験 ALK融合遺伝子陽性非小細胞肺がん 2 第3世代ALK-TKI、または第3世代ALK-TKI+プラチナ併用化学療法 臨床試験 PS不良進展型小細胞肺がん 2 プラチナ併用化学療法+抗PD-L1抗体
- LAM(肺リンパ脈管筋腫症)グループ
-
LAM(リンパ脈管筋腫症)グループの研究テーマ
LAMグループは、希少肺疾患の一つであるリンパ脈管筋腫症(LAM)の診療・研究を中心に、Birt-Hogg-Dubé症候群(BHDS)、α1-アンチトリプシン欠乏症(AATD)、嚢胞性肺疾患、等の関連する他の希少呼吸器疾患を研究しています。研究設備の整った大学病院の使命として、common diseaseのみならず希少疾患の診療・研究を発展させることが挙げられます。患者さんの診療とともに、解明しなければならないclinical questionsに一つ一つ取り組んで、臨床研究と基礎研究を進めています。研究を進める上では、学内外を問わず様々な分野の医師や研究者との連携や協力が必要で、「患者さんのために」、の想いをもって積極的に共同研究を進めています。1)臨床研究
- LAM、BHDS、AATDの診断基準の作成
厚生労働科学研究費補助金事業「難治性呼吸器疾患・肺高血圧症に関する調査研究班」の班員として関わっています。 - LAMとAATDのレジストリー
日本呼吸器財団、日本呼吸器学会の支援を受けて、2疾患のレジストリー研究の事務局をしています。 - BHDSでは、診断基準の確立を目指して日本気胸・嚢胞性肺疾患学会の会員施設と共同研究を行っています。
- LAM、BHD、AATD、嚢胞性肺疾患の診療から得られる臨床情報を用い、観察研究を行っています。画像解析はその一つで、各疾患の病態解析、鑑別診断、等に役立つ研究成果を発表しています。
2)基礎研究
- LAM患者さんの臨床検体を用い、LAM細胞やリンパ管内皮細胞を分離し、細胞株の樹立、細胞培養、などを通して病態解明を目指した研究をしています。また、バイオマーカーの探索を目指した研究に取り組んでいます。我々の研究業績の一つとして、LAM病巣には豊富なリンパ管が存在し、リンパ管内皮細胞増殖因子であるVEGF-DがLAM患者の血清中で高値であることを見出したことが挙げられます。LAM細胞はVEGF-Dを産生し、病巣内にリンパ管新生を誘導し、それに伴いLAM細胞クラスターがリンパ流中に放出され、LAM細胞の転移・病態の進展が生じる、との仮説を提唱しました(図1)。LAM患者さんの肺組織からLAM細胞、リンパ管内皮細胞を分離・培養し、病態解明の研究に取り組んでいます。
- BHDSでは、患者さんの肺組織から線維芽細胞、II型肺胞上皮細胞、中皮細胞、等を培養しFLCN遺伝子異常による機能的変化を明らかにし、病態解明を目指しています。
我々は、嚢胞性肺疾患患者のFLCN遺伝子解析を行い、国内で初めてBHDS患者を診断し報告しました。また、BHDS患者の肺から分離した肺線維芽細胞の機能異常を証明し、肺のう胞の形成にはFLCN遺伝子のhaploinsufficiencyによる肺細胞機能障害が関与する可能性を始めて報告しました(図2)。また、BHDS患者の胸膜中皮細胞を分離・培養し、線維芽細胞と同様にFLCN haploinsufficiencyにより機能異常に陥っていることを見出しました。 - AATDでは、日本人に高頻度に認められる新しい欠損型α1-アンチトリプシン遺伝子PI*Siiyamaを同定し、日本人AATDは欧米とは異なる遺伝子異常によることを報告しました。その後も、ヨーロッパの研究者との共同研究により血中濃度の低下に至るα1-アンチトリプシン分子の立体構造変化の研究について関わってきました。
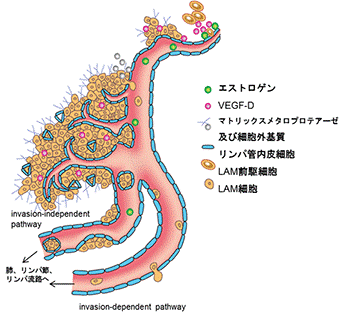 図1.LAMの進展におけるリンパ管新生、LAM細胞クラスターの役割
図1.LAMの進展におけるリンパ管新生、LAM細胞クラスターの役割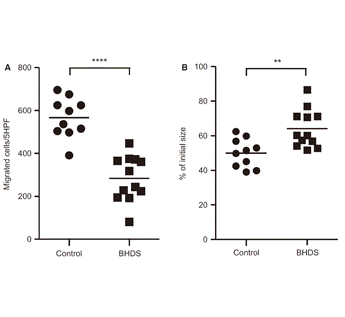 図2.BHDS肺線維芽細胞の遊走能(A)やゲル収縮能(B)の低下
図2.BHDS肺線維芽細胞の遊走能(A)やゲル収縮能(B)の低下LAMに関する最近の主要な業績論文
- Nishino K, Yoshimatsu Y, Muramatsu T, Sekimoto Y, Mitani K, Kobayashi E, Okamoto S, Ebana H, Okada Y, Kurihara M, Suzuki K, Inazawa J, Takahashi K, Watabe T, Seyama K; Isolation and characterisation of lymphatic endothelial cells from lung tissues affected by lymphangioleiomyomatosis. Sci Rep. 2021 Apr 16;11(1):8406.
- Sekimoto Y, Suzuki K, Okura M, Hayashi T, Ebana H, Kumasaka T, Mitani K, Nishino K, Okamoto S, Kobayashi E, Takahashi K, Seyama K.; Uncommon radiologic computed tomography appearances of the chest in patients with lymphangioleiomyomatosis. Sci Rep. 2021 Mar 30;11(1):7170.
- Ko Y, Asakawa K, Tobino K, Oguma T, Hirai T, Takada T, Takahashi K, Seyama K; Multicenter Lymphangioleiomyomatosis Sirolimus Trial for Safety Study Group. Quantitative analysis of computed tomography of the lungs in patients with lymphangioleiomyomatosis treated with sirolimus. Heliyon. 2020;6:e03345.
- Kato M, Kanehiro Y, Yoshimi K, Kodama Y, Sekiya M, Sato T, Takahashi K, Seyama K; Multicenter Lymphangioleiomyomatosis Sirolimus Trial for Safety Study Group. COPD assessment test as a possible tool for evaluating health-related quality of life in lymphangioleiomyomatosis. Respir Investig. 2018 Nov;56(6):480-488.
- Kobayashi K, Miki Y, Saito R, Adachi K, Seyama K, Okada Y, Sasano H. Roles of human epidermal growth factor receptor family in pulmonary lymphangioleiomyomatosis. Hum Pathol. 2018 Nov;81:121-130.
BHDに関する最近の主要な業績論文
- Shouichi Okamoto, Hiroki Ebana, Masatoshi Kurihara, Keiko Mitani, Etsuko Kobayashi, Takuo Hayashi, Yasuhito Sekimoto, Koichi Nishino, Mizuto Otsuji, Toshio Kumasaka, Kazuhisa Takahashi, Kuniaki Seyama. Folliculin Haploinsufficiency Causes Cellular Dysfunction of Pleural Mesothelial Cells. Sci Rep. 2021 May 24;11(1):10814.
- Mizobuchi T, Kurihara M, Ebana H, Yamanaka S, Kataoka H, Okamoto S, Kobayashi E, Kumasaka T, Seyama K. A total pleural covering of absorbable cellulose mesh prevents pneumothorax recurrence in patients with Birt-Hogg-Dubé syndrome. Orphanet J Rare Dis. 2018 May 15;13(1):78.
- Iwabuchi C, Ebana H, Ishiko A, Negishi A, Mizobuchi T, Kumasaka T, Kurihara M, Seyama K. Skin lesions of Birt-Hogg-Dubé syndrome: Clinical and histopathological findings in 31 Japanese patients who presented with pneumothorax and/or multiple lung cysts. J Dermatol Sci. 2018 Jan;89(1):77-84.
- Ebana H, Mizobuchi T, Kurihara M, Kobayashi E, Haga T, Okamoto S, Takahashi K, Seyama K. Novel clinical scoring system to identify patients with pneumothorax with suspicion for Birt-Hogg-Dubé syndrome. Respirology. 2018 Apr;23(4):414-418.
- Hoshika Y, Takahashi F, Togo S, Hashimoto M, Nara T, Kobayashi T, Nurwidya F, Kataoka H, Kurihara M, Kobayashi E, Ebana H, Kikkawa M, Ando K, Nishino K, Hino O, Takahashi K, Seyama K. Haploinsufficiency of the folliculin gene leads to impaired functions of lung fibroblasts in patients with Birt-Hogg-Dubé syndrome. Physiol Rep. 2016 Nov;4(21). pii: e13025.
AATDに関する最近の主要な業績論文
- Seyama K, Nukiwa T, Sato T, Suzuki M, Konno S, Takahashi K, Nishimura M, Steinmann K, Sorrells S, Chen J, Hayashi KI. Safety and pharmacokinetics of Alpha-1 MP (Prolastin®-C) in Japanese patients with alpha1-antitrypsin (AAT) deficiency. Respir Investig. 2019 Jan;57(1):89-96.
- Callea F, Giovannoni I, Francalanci P, Boldrini R, Faa G, Medicina D, Nobili V, Desmet VJ, Ishak K, Seyama K, Bellacchio E. Mineralization of alpha-1-antitrypsin inclusion bodies in Mmalton alpha-1-antitrypsin deficiency. Orphanet J Rare Dis. 2018 May 16;13(1):79.
- Seyama K, Hirai T, Mishima M, Tatsumi K, Nishimura M; Respiratory Failure Research Group of the Japanese Ministry of Health, Labour, and Welfare. A nationwide epidemiological survey of alpha1-antitrypsin deficiency in Japan. Respir Investig. 2016 May;54(3):201-6.
- Seyama K, Nukiwa T, Souma S, Shimizu K, Kira S. Alpha 1-antitrypsin-deficient variant Siiyama (Ser53[TCC] to Phe53[TTC]) is prevalent in Japan. Status of alpha 1-antitrypsin deficiency in Japan. Am J Respir Crit Care Med. 1995; 152(6 Pt 1): 2119-26.
- LAM、BHDS、AATDの診断基準の作成
- COPDグループ
-
慢性閉塞性肺疾患(COPD)研究
慢性閉塞性肺疾患 (COPD)は、タバコ煙を主とする有害物質を長期に吸入曝露することで生じる慢性呼吸器疾患です。COPDの中心的な発症メカニズムは、喫煙・大気汚染物質の吸入などによる、気道や肺の慢性的な炎症反応であり、この炎症反応は禁煙後も持続すると考えられています。したがって、COPDの患者さんでは、呼吸器局所での炎症の制御機構に何らかの異常が生じていることが推測されますが、その全貌は未だ明らかになっていません。COPDリサーチグループでは、COPDの病態解明と新規治療法の確立を目指して、様々な角度から研究を進めており、国内外の学会での発表および、学術誌への論文発表を精力的に行っています。老化モデルマウスを用いたCOPD病態の解明、COPD治療への挑戦
COPDは長期間の喫煙歴のある比較的高齢の方に発症することから、COPDの病態に老化が関わることが推測されていました。私たちは、東京都健康長寿医療センター研究所との共同研究で、老化モデルマウスにタバコ煙曝露を行った結果、通常のマウスよりも短期間でマウスの肺にCOPD病変(肺気腫)を発症することを発見しました(下図)[1]。その後、その老化モデルマウスがビタミンCを合成できない(通常のマウスはビタミンCを自分で作ることができる)ことが分かったため[2]、喫煙によりCOPDとなったマウスに十分量のビタミンCを与えたところ、破壊された肺胞構造が修復されることを見出しました[3]。さらに、私たちは最近の研究で、アンチエイジング効果が期待され話題となっている水素水をこの老化モデルマウスに与えながらタバコ煙曝露を行ったところ、水素水を与えずに喫煙させたマウスと比較して肺胞構造の破壊が軽度となることを見出し、水素水によるCOPD発症予防効果を報告しました[4]。また、国立長寿医療研究センターと共同で、老化した細胞を人工的に除去できるマウスを用いて老化現象と肺気腫との関係をみる研究を継続しており、老化した細胞を除去することで肺気腫発症を抑えることができる可能性を報告しました[5-7]。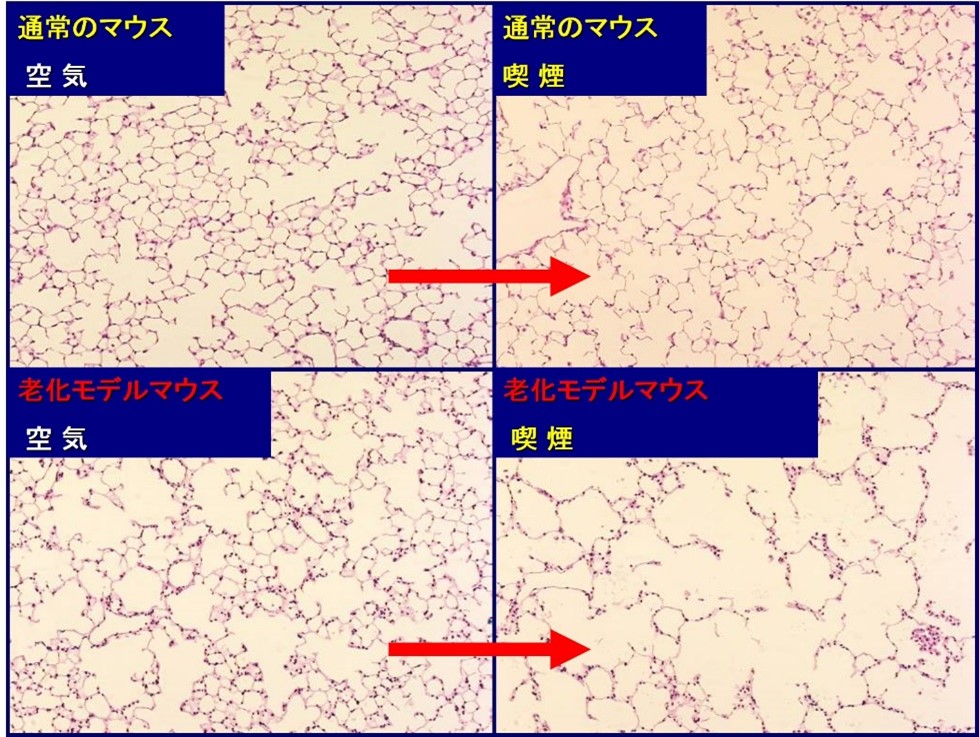
通常のマウスと老化モデルマウスそれぞれに8週間、新鮮大気あるいはタバコを吸入させたところ、
老化モデルマウスでは喫煙後、肺胞構造が破壊される肺気腫病変を形成した(右下)。マイクロRNAによる新しいCOPD治療を目指した気道分泌型エクソソーム解析
COPDリサーチチームリーダーの佐藤匡は、米国での留学中に、COPD病態の中心と考えられる異常な炎症反応が特定のマイクロRNAにより制御されることを報告しました[8]。マイクロRNAは遺伝子の発現を調節するという重要な役割を持っていることが分かっていますが、COPDの細胞では、炎症反応により誘導される遺伝子の発現を調節(抑制)し、炎症を抑える働きがあるマイクロRNAが十分に作られないことで、喫煙などによる炎症反応が適切に抑えられず、肺胞構造の破壊に至るのではないかと考えられます。そうしたマイクロRNAを補充することができれば、COPDの異常な炎症反応を抑えることができ、うまくすると壊れた肺胞を修復できるかもしれません[9]。また一方、マイクロRNAの生体内での運び手としてエクソソームという細胞から分泌される小さな袋のようなものが注目されています。現在、COPDリサーチグループでは、COPDを治療できる候補となるマイクロRNAを同定し、エクソソームを用いてそうしたマイクロRNAを呼吸器組織に届けることができないか、研究を進めています。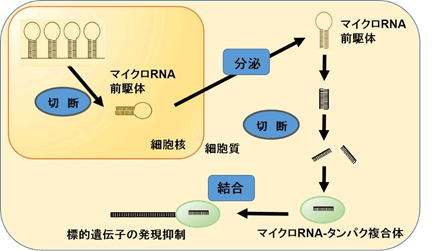
肺気腫におけるグルコシルセラミドの役割
COPDにおいて、セラミドを含むスフィンゴ脂質は肺胞破壊に重要な調節因子で、肺気腫発症に深く関わることが報告されていました[10]。COPDリサーチメンバーの小池健吾は、その報告を行ったアメリカ・デンバーの研究室へ留学をし、喫煙と肺内のスフィンゴ脂質との関連について詳細な研究を行いました。その結果、喫煙によって肺内のグリコシルセラミドが減少し、このことが肺血管内皮細胞のアポトーシス(細胞死)を誘導し、肺気腫の発症に関与することを見出し、呼吸器病学で最高にインパクトのある雑誌であるAmerican Journal of Respiratory and Critical Care Medicine誌に論文発表を行いました[11]。吸入手技の再指導によるCOPD患者の吸入デバイス満足度の変化に関する調査研究
COPDに対しての標準的な治療法は気管支拡張薬の吸入です。症状や呼吸機能によって薬剤の選択をしていきますが、吸入器(デバイス)も多くの種類があります。われわれ医師が個々の患者さんに合わせて処方をするのですが、実際に使われている患者さんの使用満足度を知ることが非常に大切であると考えています。COPD患者さんでは、吸入デバイスの満足度が高いとアドヒアランス(なぜ服薬しなければならないかを患者さんが十分に理解して吸入すること)が上がり、アドヒアランスがよいほどCOPDのコントロールがよいとの報告があります。また、COPD患者さんでは吸入デバイスの使用ミスが多く、吸入指導により吸入ミスが改善するとの報告があります。処方した吸入器が適切に使用されているか確認することも重要と考えています。そこで当院では、COPDと診断され、吸入薬による治療を3ヵ月以上継続されている患者さんを対象に、吸入再指導を行うことで吸入デバイスへの満足度やアドヒアランス、吸入手技エラーの有無などについて調査させていただくことをお願いしております。私たちは、COPD患者さんとともに、COPD治療をより個々に適した満足度の高いものにしていきたいと考えています。加熱式タバコの長期使用による肺傷害の解析
わが国において加熱式タバコは若年者を中心に急速に普及しています。加熱式タバコのエアロゾルには多数の有害物質が含まれていることが証明されていますが、加熱式タバコの流行とともに、加熱式タバコは無害であり禁煙効果があるといった情報も広まっており、加熱式タバコが禁煙意欲の阻害や適切な禁煙治療の妨げとなっている可能性があるのではないかと考えました。そこで、当院の禁煙外来を受診された患者の加熱式タバコの使用有無、喫煙本数、既往歴などを含めた臨床データや禁煙達成率を含めた治療転帰など、加熱式タバコと禁煙の関係について調査を行っています。また、私たちは、実験マウスに加熱式タバコエアロゾルを6か月間曝露させる実験を行いました。その結果、加熱式タバコエアロゾルを曝露されたマウスでは、紙巻きタバコと同様に、肺にCOPD病変(肺気腫)を発症することを証明し、American Journal of Physiology Lung Cellular and Molecular Physiology誌上に発表しました[12]。また、加熱式タバコのエアロゾルに特異的に多く含まれる成分のうち、とりわけプロピレングリコールが気道上皮細胞の細胞機能に悪影響を与えることを証明し、Respiratory Research誌に報告しました[13]。病変を生じるメカニズムについては従来の紙巻きタバコとはやや異なる可能性もあり、詳細な解析を続けています。
従来の紙巻きタバコによる、COPDをはじめとした健康被害はすでに広く知られていますが、その多くは長年におよぶ喫煙の結果発症します。私たちの研究から、加熱式タバコを長期に使用することによる肺傷害など健康被害リスクはあるものと考えられ、治療法の開発も視野に入れた研究を継続するとともに、加熱式タバコを含めた禁煙の重要性について広く発信していきたいと考えています。 マウスに6か月間、新鮮大気、加熱式タバコエアロゾル、紙巻きタバコ煙を曝露させたところ、加熱式タバコエアロゾル曝露では、紙巻きタバコ煙曝露と同様に、肺胞構造が破壊される肺気腫病変を形成した。
マウスに6か月間、新鮮大気、加熱式タバコエアロゾル、紙巻きタバコ煙を曝露させたところ、加熱式タバコエアロゾル曝露では、紙巻きタバコ煙曝露と同様に、肺胞構造が破壊される肺気腫病変を形成した。文 献
- Sato T, Seyama K, Sato Y, Mori H, Souma S, Akiyoshi T, Kodama Y, Mori T, Goto S, Takahashi K, et al: Senescence marker protein-30 protects mice lungs from oxidative stress, aging, and smoking. Am J Respir Crit Care Med 2006, 174:530-537.
- Kondo Y, Inai Y, Sato Y, Handa S, Kubo S, Shimokado K, Goto S, Nishikimi M, Maruyama N, Ishigami A: Senescence marker protein 30 functions as gluconolactonase in L-ascorbic acid biosynthesis, and its knockout mice are prone to scurvy. Proc Natl Acad Sci U S A 2006, 103:5723-5728.
- Koike K, Ishigami A, Sato Y, Hirai T, Yuan Y, Kobayashi E, Tobino K, Sato T, Sekiya M, Takahashi K, et al: Vitamin C Prevents Cigarette Smoke-Induced Pulmonary Emphysema in Mice and Provides Pulmonary Restoration. Am J Respir Cell Mol Biol 2013.
- Suzuki Y, Sato T, Sugimoto M, Baskoro H, Karasutani K, Mitsui A, Nurwidya F, Arano N, Kodama Y, Hirano SI, et al: Hydrogen-rich pure water prevents cigarette smoke-induced pulmonary emphysema in SMP30 knockout mice. Biochem Biophys Res Commun 2017, 492:74-81.
- Hashimoto M, Asai A, Kawagishi H, Mikawa R, Iwashita Y, Kanayama K, Sugimoto K, Sato T, Maruyama M, Sugimoto M: Elimination of p19(ARF)-expressing cells enhances pulmonary function in mice. JCI Insight 2016, 1:e87732.
- Mikawa R, Suzuki Y, Baskoro H, Kanayama K, Sugimoto K, Sato T, Sugimoto M: Elimination of p19(ARF)-expressing cells protects against pulmonary emphysema in mice. Aging Cell 2018, 17:e12827.
- Mikawa R, Sato T, Suzuki Y, Baskoro H, Kawaguchi K, Sugimoto M: p19(Arf) Exacerbates Cigarette Smoke-Induced Pulmonary Dysfunction. Biomolecules 2020, 10.
- Sato T, Liu X, Nelson A, Nakanishi M, Kanaji N, Wang X, Kim M, Li Y, Sun J, Michalski J, et al: Reduced miR-146a increases prostaglandin E(2)in chronic obstructive pulmonary disease fibroblasts. Am J Respir Crit Care Med 2010, 182:1020-1029.
- Sato T, Baskoro H, Rennard SI, Seyama K, Takahashi K: MicroRNAs as Therapeutic Targets in Lung Disease: Prospects and Challenges. Chronic Obstr Pulm Dis 2015, 3:382-388.
- Petrache I, Natarajan V, Zhen L, Medler TR, Richter AT, Cho C, Hubbard WC, Berdyshev EV, Tuder RM: Ceramide upregulation causes pulmonary cell apoptosis and emphysema-like disease in mice. Nat Med 2005, 11:491-498.
- Koike K, Berdyshev EV, Mikosz AM, Bronova IA, Bronoff AS, Jung JP, Beatman EL, Ni K, Cao D, Scruggs AK, et al: Role of Glucosylceramide in Lung Endothelial Cell Fate and Emphysema. Am J Respir Crit Care Med 2019, 200:1113-1125.
- Nitta NA, Sato T, Komura M, Yoshikawa H, Suzuki Y, Mitsui A, Kuwasaki E, Takahashi F, Kodama Y, Seyama K, Takahashi K: Exposure to the heated tobacco product IQOS generates apoptosis-mediated pulmonary emphysema in murine lungs. Am J Physiol Lung Cell Mol Physiol 2022, 322:L699-L711.
- Komura M, Sato T, Yoshikawa H, Nitta NA, Suzuki Y, Koike K, Kodama Y, Seyama K, Takahashi K: Propylene glycol, a component of electronic cigarette liquid, damages epithelial cells in human small airways. Respir Res 2022,
23:216.
- 気管支喘息グループ
-
喘息グループ研究テーマ
喘息グループでは、本学免疫学講座やアトピーセンター、慶應大学、国立病院機構模原病院、国立がん研究センター、国立研究開発法人理化学研究所、埼玉医科大学、佐賀大学、昭和大学、帝京大学、東京女子医科大学、日本大学などの他施設との共同研究を行っています。以下に主な研究を列挙させていただきます。
- 喘息と自然リンパ球
- 喘息におけるMAIT細胞の役割
- 喘息に対する生物学的製剤がもたらす免疫調節作用
- 喘息における新規バイオマーカーの開発
- スギ花粉症合併喘息に対するスギ花粉舌下免疫療法の有用性
- 免疫チェックポイント分子、補助シグナル分子と呼吸器疾患
- 喘息におけるステロイド抵抗性のメカニズム
- 喘息における上皮間葉転換
- 間質性肺炎における気管支肺胞洗浄液中リンパ球分画に関する網羅的解析
- 居住空間の空気質モニター
- 携帯電話のアプリを用いた我が国の気管支喘息実態調査
- そのほか
- 喘息グループの受賞歴
喘息と自然リンパ球
喘息における炎症の主体は獲得免疫応答によるTh2型免疫のみならず、自然免疫応答も重要であることが分かっています。喘息における自然免疫はウイルス感染やタバコ煙、気候の変化などの抗原非特異的な刺激との関与も想定されています。自然リンパ球には、T細胞抗原受容体(TCR)を持たないグループであるinnate lymphoid cell(ILC)いわゆる自然リンパ球がよく知られていますが、TCRを有するも単一性で多様性のないTCRしか持たないグループも存在します。この後者には、NKT細胞、γδT細胞やmucosal-associated invariant T (MAIT)細胞が含まれます。ILCは、産生するサイトカインによってさらに3つのグループ、1型自然リンパ球(IFN-γを産生する)、2型自然リンパ球(IL-5やIL-13を産生する)、3型自然リンパ球(IL-17やIL-22を産生する)に分類されます。私たちは、喘息患者さんの末梢血中では、1型、2型、3型のILC、MAIT細胞のそれぞれが一様に活性化している可能性を報告し、Allergology InternationalのEditor's choicesで紹介されました。
Ishimori A, Harada N, Chiba A, Harada S, Matsuno K, Makino F, Ito J, Ohta S, Ono J, Atsuta R, Izuhara K, Takahashi K, Miyake S. Circulating activated innate lymphoid cells and mucosal-associated invariant T cells are associated with airflow limitation in patients with asthma. Allergol Int 2017; 66: 302-309.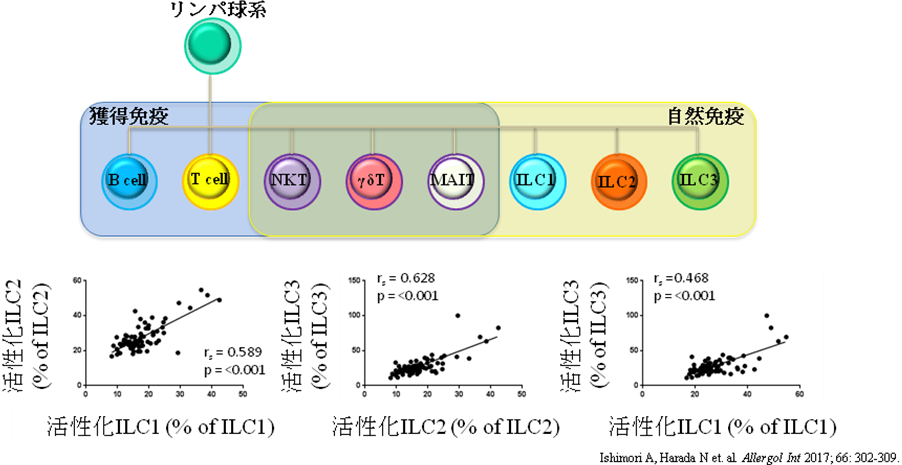
喘息におけるMAIT細胞の役割
私たちは、上記の報告の中で、活性化MAIT細胞が重症喘息患者さんで低値であることを示しています。これを受けて、喘息におけるMAIT細胞の役割に関してマウスを用いた解析を行いました。OVA誘導性喘息モデルマウスでは肺内MAIT細胞が増加し、MAIT細胞欠失(MR1)マウスではOVA誘導性喘息が悪化したことから、OVA誘導性喘息モデルマウスではMAIT細胞は抑制性に働くことを示しました。Sasano H, Harada N, Harada S, Takeshige T, Sandhu Y, Tanabe Y, Ishimori A, Matsuno K, Nagaoka T, Ito J, Chiba A, Akiba H, Atsuta R, Izuhara K, Miyake S, Takahashi K. Pretreatment circulating MAIT cells, neutrophils, and periostin predicted the real-world response after 1-year mepolizumab treatment in asthmatics. Allergol Int. 2023; 17:S1323-8930(23)00050-3.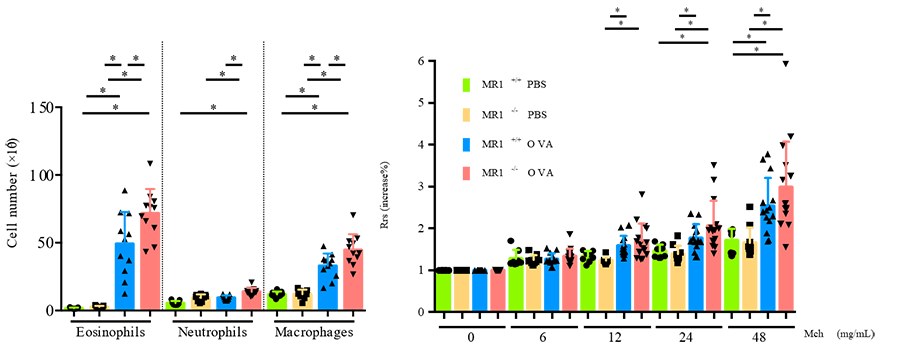
喘息に対する生物学的製剤がもたらす免疫調節作用
現在、最重症喘息の治療に生物学的製剤があり、多くの患者さんがその効果を実感されていらっしゃいます。しかし、これらの生物学的製剤がもたらす生体内で免疫調節作用の詳細は明らかではありません。私たちは、生物学的製剤の使用前後での免疫担当細胞の変化をフローサイトメトリーやRNA解析を用いて解析しています。2022年度は一部の成果の論文投稿を予定しています。Harada N, Ito J, Takahashi K. Clinical effects and immune modulation of biologics in asthma. Respitratory Investigation 2021; 59: 389-396.喘息における新規バイオマーカーの開発
生物学的製剤は、非常に高価であることから、生物学的製剤の効果を予測するバイオマーカーの開発は世界的にも喫緊の課題です。私たちは、上記の自然リンパ球分画を中心に、生物学的製剤や気管支サーモプラスティによる治療効果を予測するバイオマーカーなどの探索を行っています。そのなかで、末梢血の活性化MAIT細胞が少ないこと、血清ペリオスチンが高値であることがメポリズマブの有効例を予測するバイオマーカーとなり得ること、末梢血Th17細胞が多いこと、FeNO高値がベンラリズマブの有効例を予測するバイオマーカーとなり得ることをそれぞれ報告しています。また、細胞外マトリックス構成タンパクであるテネイシンCについては、血清テネイシンCとペリオスチンあるいはIgEの組み合わせが喘息のバイオマーカーとなりうる可能性を報告しています。Sasano H, Harada N, Harada S, Takeshige T, Sandhu Y, Tanabe Y, Ishimori A, Matsuno K, Nagaoka T, Ito J, Chiba A, Akiba H, Atsuta R, Izuhara K, Miyake S, Takahashi K. Pretreatment circulating MAIT cells, neutrophils, and periostin predicted the real-world response after 1-year mepolizumab treatment in asthmatics. Allergol Int. 2023; 17:S1323-8930(23)00050-3.Sandhu Y, Harada N, Sasano H, Harada S, Ueda S, Takeshige T, Tanabe Y, Ishimori A, Matsuno K, Abe S, Nagaoka T, Ito J, Chiba A, Akiba H, Atsuta R, Izuhara K, Miyake S, Takahashi K. Pretreatment Frequency of Circulating Th17 Cells and FeNO Levels Predicted the Real-World Response after 1 Year of Benralizumab Treatment in Patients with Severe Asthma. Biomolecules. 2023 Mar 15;13(3):538.Yasuda M, Harada N, Harada S, Ishimori A, Katsura Y, Itoigawa Y, Matsuno K, Makino F, Ito J, Ono J, Tobino K, Akiba H, Atsuta R, Izuhara K, Takahashi K. Characterization of tenascin-C as a novel biomarker for asthma: utility of tenascin-C in combination with periostin or immunoglobulin E.Allergy Asthma Clin Immunol 2018; 14: 72.スギ花粉症合併喘息に対するスギ花粉舌下免疫療法(sublingual immunotherapy:SLIT)の有用性
スギ花粉症合併喘息に対する1年間のSLITは、アレルギー性鼻炎の症状改善効果だけでなく、スギ花粉飛散シーズン中の喘息症状も大幅に改善し、オフシーズン中の気道抵抗も改善したことを報告しました。 この報告のなかで、SLIT後のスギ花粉飛散シーズン中の喘息症状の改善がシーズンオフの末梢血γδT細胞の減少と関連する可能性を示しています。Ueda S, Ito J, Harada N, Harada S, Sasano H, Sandhu Y, Tanabe Y, Abe S, Shiota S, Kodama Y, Nagaoka T, Makino F, Chiba A, Akiba H, Atsuta R, Miyake S, Takahashi K. Effect of Japanese Cedar Pollen Sublingual Immunotherapy on Asthma Patients with Seasonal Allergic Rhinitis Caused by Japanese Cedar Pollen. Biomolecules 2022; 12: 518.免疫チェックポイント分子、補助シグナル分子と呼吸器疾患
私たちは、これまで免疫チェックポイント分子、補助シグナル分子の呼吸器疾患における役割を解析してきました。現在は、T cell immunoglobulin and mucin domain(TIM)ファミリー分子に関して喘息への関与を解析しています。現在は、本学免疫学講座と可溶型TIM-4についての解析を行い論文投稿中です。Isshiki T, Akiba H, Nakayama M, Harada N, Okumura K, Homma S, Miyake S. Cutting Edge: Anti-TIM-3 Treatment Exacerbates Pulmonary Inflammation and Fibrosis in Mice.J Immunol 2017; 199: 3733-3737.喘息におけるステロイド抵抗性のメカニズム
生物学的製剤の登場もあり難治性喘息にかかる医療費は高騰しています。ステロイド抵抗性喘息は難治性喘息の代表であり、難治性喘息治療を改善する目的のみならず医療経済面からもステロイド抵抗性喘息のメカニズム解明は喫緊の課題です。私たちは、ステロイド抵抗性喘息マウスモデルを作製し、そのメカニズムを解析しています。キチンはダニや真菌など多くの喘息増悪因子が有する多糖類ですが、このキチンが誘導するステロイド抵抗性喘息マウスモデルを確立し、肺胞マクロファージが産生するIL-1βとTh17細胞がステロイド抵抗性に関与する可能性を報告しました。キチンはダニや昆虫、甲殻類、真菌に多く含まれ環境中に豊富に存在します。これを吸入することがステロイド抵抗性の一因になることが考えられ、環境整備の重要性が強調されました。現在は、さらにステロイド抵抗性メカニズムの解明を目指して解析を進めています。Takeshige T, Harada N, Harada S, Ishimori A, Katsura Y, Sasano H, Sandhu Y, Matsuno K, Makino F, Ito J, Atsuta R, Akiba H, Takahashi K. Chitin induces steroid-resistant airway inflammation and airway hyperresponsiveness in mice. Allergol Int 2021; 70: 343-350.喘息における上皮間葉転換
喘息管理が不十分であると気道リモデリングが進行し、重症化してしまいます。この気道リモデリングには、上皮間葉転換(EMT : epithelial mesenchymal transition)の関与が報告されています。EMTを誘導する重要な因子にTGF-βがありますが、私たちは、気道上皮細胞が傷つくとTGF-βが産生されEGFRを介した創傷治癒を誘導すること、TNFαスーパーファミリーのTWEAKがTGF-βとともに気道上皮細胞にEMTを誘導することなどを報告してきました。私たちは、このEMTを起こした気道上皮細胞において、喘息における獲得免疫と自然免疫双方に関わるサイトカインTSLP(thymic stromal lymphopoietin)の産生が増強することを報告しています。さらに、この過程に新規MAPKKKの一つであるMAP3K19が介在する可能性について報告を行っています。MAP3K19は、肺に特異的に発現しているものの、生体内での役割は明らかではなく、喘息への関与も不明であった。MAP3K19ノックダウン気道上皮細胞は上記EMTとRANTES、および、TSLP産生を増強し、MAP3K19ノックアウトマウスでは好酸球性気道炎症の悪化が示された。これらから、MAP3K19が喘息におけるアレルギー性気道炎症を調節している可能性が示唆されている。Yuuki Sandhu, Norihiro Harada, Sonoko Harada, Takayasu Nishimaki, Hitoshi Sasano, Yuki Tanabe, Tomohito Takeshige, Kei Matsuno, Ayako Ishimori, Yoko Katsura, Jun Ito, Hisaya Akiba, Kazuhisa Takahashi, MAP3K19 Affects TWEAK-Induced Response in Cultured Bronchial Epithelial Cells and Regulates Allergic Airway Inflammation in an Asthma Murine Model, Curr. Issues Mol. Biol. 2023, 45(11), 8907-8924.Matsuno K, Harada N, Harada S, Takeshige T, Ishimori A, Itoigawa Y, Katsura Y, Kodama Y, Makino F, Ito J, Atsuta R, Akiba H, Takahashi K. Combination of TWEAK and TGF-beta1 induces the production of TSLP, RANTES, and TARC in BEAS-2B human bronchial epithelial cells during epithelial-mesenchymal transition. Exp Lung Res 2018; 44: 332-343.Itoigawa Y, Harada N, Harada S, Katsura Y, Makino F, Ito J, Nurwidya F, Kato M, Takahashi F, Atsuta R, Takahashi K. TWEAK enhances TGF-beta-induced epithelial-mesenchymal transition in human bronchial epithelial cells. Respir Res 2015; 16: 48.間質性肺炎における気管支肺胞洗浄液中リンパ球分画に関する網羅的解析
間質性肺炎の鑑別は容易ではありません。私たちは、間質性肺炎における気管支肺胞洗浄液中自然リンパ球分画を解析しています。上記の自然リンパ球を中心に、その意義を明らかにすることで、間質性肺炎の病態解明ならびに鑑別に有用なバイオマーカーを確立することを目的としています。居住空間の空気質モニター
喘息症状管理には薬物治療に加えて重要なことがあります。受動喫煙などの環境による喘息悪化因子の除去です。現在の社会では、空気清浄機の普及や建築材料の改善により、屋内における空気の質はよりよく改善されていますが、住宅の高気密化や換気不足などから必ずしも喘息にとってよりよい室内環境になっているかは定かではありません。そこで、患者さんご自宅の空気の質をモニターさせていただき、喘息症状管理と空気の質との関連を解析しています。携帯電話のアプリを用いた我が国の気管支喘息実態調査
iPhoneのアプリ「ぜんそくログ」を開発し、喘息実態調査を携帯端末より行った日本ではじめての研究でした。ご参加いただいた方々には、この場をお借りして、あらためまして御礼申し上げます。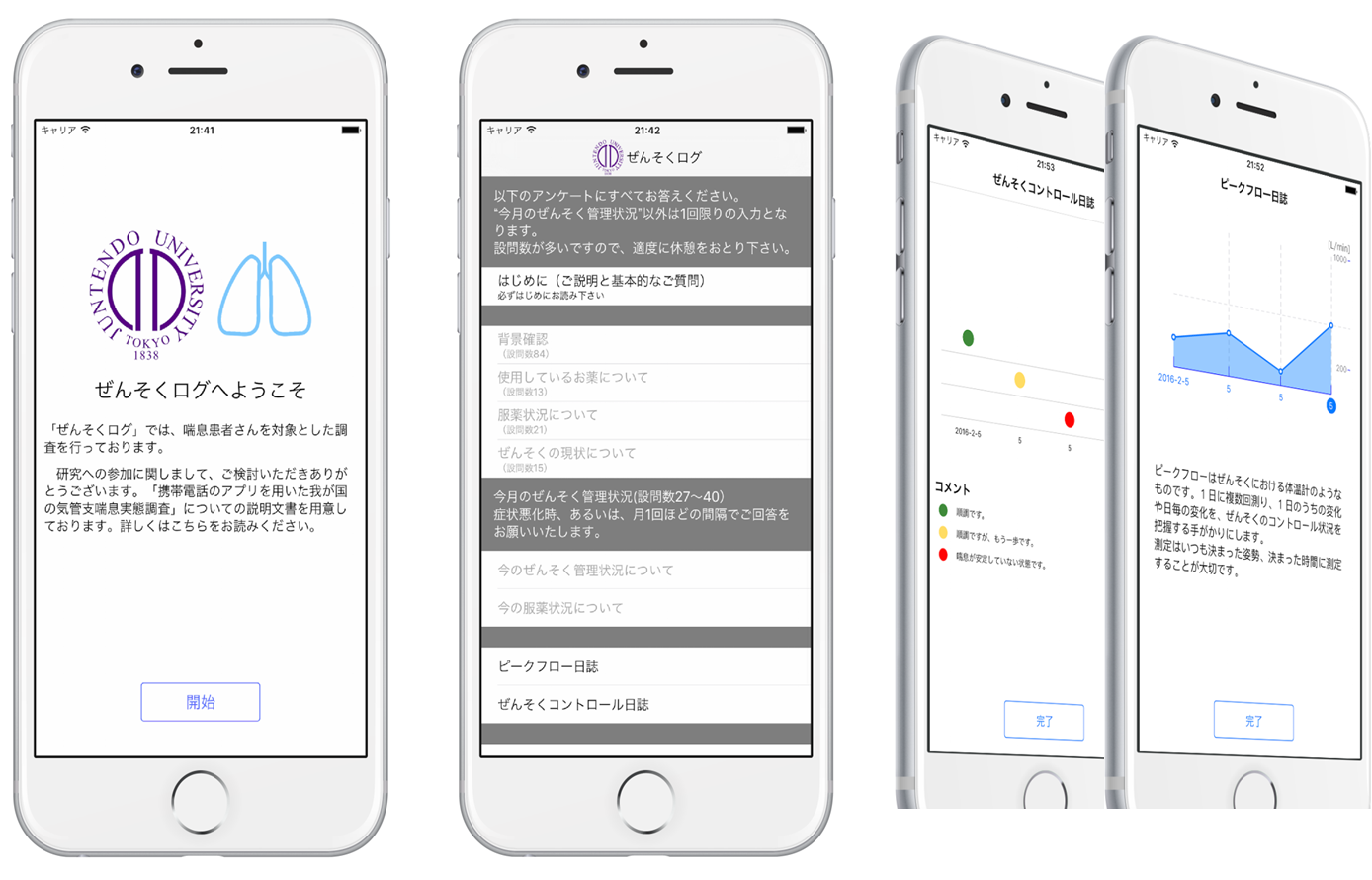 Harada N, Harada S, Ito J, Atsuta R, Hori S, Takahashi K. Mobile Health App for Japanese Adult Patients With Asthma: Clinical Observational Study. J Med Internet Res 2020; 22: e19006.
Harada N, Harada S, Ito J, Atsuta R, Hori S, Takahashi K. Mobile Health App for Japanese Adult Patients With Asthma: Clinical Observational Study. J Med Internet Res 2020; 22: e19006.そのほか
呼気一酸化窒素濃度(FeNO)の測定機種差(NOA280i®とNIOXvero®)の比較検討を行い1,369症例のデータ解析の結果を報告しています。Tanabe Y, Harada N, Ito J, Matsuno K, Takeshige T, Harada S, Takemasa M, Kotajima M, Ishimori A, Katsura Y, Makino F, Atsuta R, Takahashi K. Difference between two exhaled nitric oxide analyzers, NIOX VERO®electrochemical hand-held analyzer and NOA280i® chemiluminescence stationary analyzer. J Asthma 2019; 56: 167-172.
オックスフォード大学のグループが行ったsystematic reviewに協力をし、軽症から中等症の喘息患者さんが治療のステップダウンを行う際、FeNOが50 ppb未満であれば、安全に吸入ステロイドを減量できる可能性について報告しています。Wang K, Verbakel JY, Oke J, Fleming-Nouri A, Brewin J, Roberts N, Harada N, Atsuta R, Takahashi K, Mori K, Fujisawa T, Shirai T, Kawayama T, Inoue H, Lazarus S, Szefler S, Martinez F, Shaw D, Pavord ID, Thomas M. Using fractional exhaled nitric oxide to guide step-down treatment decisions in patients with asthma: a systematic review and individual patient data meta-analysis. Eur Respir J 2020; 55: 1902150.
全国多施設共同コホート研究への参加:複数生物学的製剤使用環境下における重症喘息前向きコホート研究、フェノタイプ・エンドタイプに着目した本邦の喘息患者における3年間予後の検討、表現型別の喘息増悪因子の同定と長期予後の解析 -2020年コホート-、気管支拡張症合併難治性喘息の実態調査(Respir Res. 2022;23(1):365.)、アレルギー性気管支肺真菌症全国実態調査(Sci Rep. 2023;13(1):5468.)などに参加し、成果を発表している。さらに、コロナ制圧タスクフォースに順天堂大学附属順天堂医院として参加し、多くの研究成果を報告しています(Nature. 2021;600(7889):472.など多数)。新型コロナウイルスから社会を守る時限的な緊急プロジェクト『コロナ制圧タスクフォース』は、様々な研究分野から日本を代表する科学者が横断的に結集したもので、科学による客観的真理を解き明かすことにより医療崩壊を防ぐことを喫緊の目標と捉え、その達成の先に、新型コロナワクチン開発を目指しています。喘息グループの受賞歴
- The 27th Congress of the Asian Pacific Society of Respirology (APSR 2023) APSR Clinical Allergy & Immunology Assembly Education Award:笹野仁史
- The 27th Congress of the Asian Pacific Society of Respirology (APSR 2023) APSR Clinical Allergy & Immunology Assembly Education Award:上田翔子
- The 27th Congress of the Asian Pacific Society of Respirology (APSR 2023) APSR Clinical Allergy & Immunology Assembly Education Award:安部寿美子
- The 27th Congress of the Asian Pacific Society of Respirology (APSR 2023) APSR Clinical Allergy & Immunology Assembly Education Award:西牧孝泰
- The 26th Congress of the Asian Pacific Society of Respirology (APSR 2022) APSR Clinical Allergy & Immunology Assembly Education Award:安部寿美子
- 第24回IREF AWARD(2022年):笹野仁史
- 第8回日本アレルギー学会関東地方会演題優秀賞(2022年):西牧孝泰
- 第7回日本アレルギー学会関東地方会演題優秀賞(2022年):安部寿美子
- The 25th Congress of the Asian Pacific Society of Respirology (APSR 2021) APSR Asthma Assembly Education Award:笹野仁史
- The 25th Congress of the Asian Pacific Society of Respirology (APSR 2021) APSR JRS Young Investigator Award:原田紀宏
- 第18回日本アレルギー学会学術大会賞(2021年):三道ユウキ
- 第6回日本アレルギー学会関東地方会演題優秀賞(2021年):上田翔子
- 第5回日本アレルギー学会関東地方会演題優秀賞(2021年):渡邉敬康
- 順天堂大学大学院医学研究科博士課程ポスターセッション優秀賞(2020年度):笹野仁史
- 第4回日本アレルギー学会地方会演題優秀賞(2020年):三道ユウキ
- 第3回日本アレルギー学会関東地方会演題優秀賞(2020年):三道ユウキ
- The 24th Congress of the Asian Pacific Society of Respirology (APSR 2019) APSR Asthma Assembly Education Award:笹野仁史
- 順天堂大学大学院医学研究科博士課程ポスターセッション優秀賞(2019年度):田辺悠記
- 第2回日本アレルギー学会関東地方会演題優秀賞(2019年):笹野仁史
- 第1回日本アレルギー学会関東地方会演題優秀賞(2019年):神後宏一
最後に、この場をお借りしまして、研究にご協力いただいた方々と関係いただいた先生方に御礼申し上げます。
- 肺循環生理グループ
-
肺高血圧・肺循環グループ
肺高血圧・肺循環グループでは、難治性疾患である肺高血圧症の病態解明・新規治療戦略の確立を目指して研究を行っています。我々のグル-プは、1990年代からエンドセリンや一酸化窒素などの肺動脈収縮・弛緩因子の病態への関与、血管平滑筋の持続的収縮におけるRhoキナーゼの役割、イソフラボンの一種であるジェニステインの肺高血圧症に対する治療効果、さらには肺動脈性肺高血圧症(Pulmonary arterial hypertension: PAH)の新規動物モデルを用いた肺高血圧症進展における肺動脈の収縮とリモデリングの役割などを報告してきました。他科との院内連携や、さらには他施設との共同研究も積極的に行いながら、様々な実験を継続しています。① PAHの血管内膜病変形成における内皮間葉転換の役割
末梢肺動脈の閉塞性内膜病変はPAHに特徴的な病変であり、肺動脈圧上昇の規定因子となることが報告されています。PAHの重要な治療標的と考えられますが、進展メカニズムは未だ明らかではありません。近年の報告で血管内皮細胞の間葉転換(Endothelial mesenchymal transition:EndMT)が、その形成に重要な役割を果たしていることが報告され注目されています。我々は各種刺激を用いてヒト肺微小血管内皮細胞にEndMTを誘導し、その進展メカニズムを明らかにすることを目的として研究を行っています。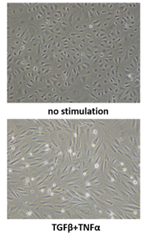
② PAHモデルラットを用いたMulti-tyrosine kinase inhibitor(TKI)の治療効果の検証
ヒトPAHに類似した血管病変を有するPAHモデルラットを用いて、幾つかの増殖因子の受容体に対するMulti-TKIの治療的効果を検証する実験を行っています。特に、PAHに特徴的な血管内膜病変の進展を抑制する効果に注目しており、抗血管リモデリング効果を有する初めてのPAH治療薬の開発を目指して研究を進めています。①②の一部については、2019年に研究結果を英文誌に報告しています(論文実績2)。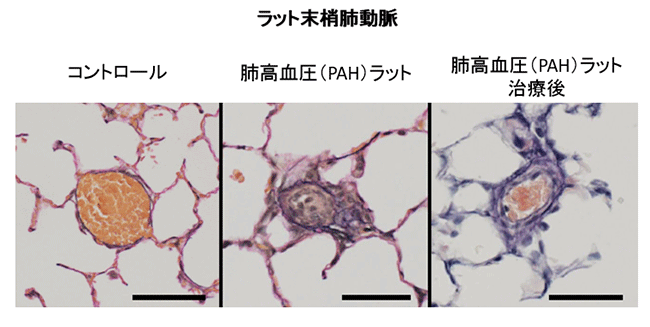
③ 肺高血圧症の血管リモデリングの同定に有用なバイオマーカーの開発
早期発見が困難なことが、PAHの臨床上の大きな問題点です。我々は組織の線維化に関わるペリオスチンという蛋白に注目して、PAHの病態進展への関与や、肺動脈の平滑筋細胞や内皮細胞の増殖の早期同定を試みる実験を行っています。細胞・動物実験でペリオスチンが肺高血圧症の病態進展に関与していることを証明し、さらにヒト肺高血圧症の血液検体を用いた検証では、PAHおよび他の肺高血圧症の血管リモデリングを早期に検出するバイオマーカーとして有用である可能性を示しました(論文実績1)。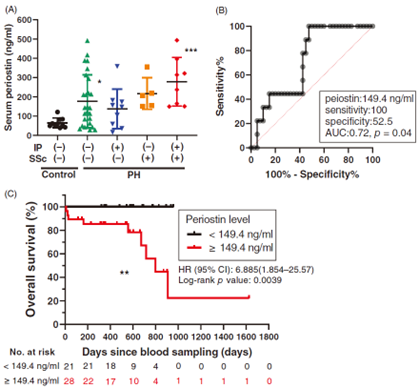
④ 膠原病関連間質性肺疾患に対する選択的肺血管拡張薬の予後延長効果の検証
臨床面においては、膠原病関連間質性肺炎に合併したPH(CTD-IP-PH)と肺疾患に伴うPH(3群PH)に対する肺血管拡張薬投与が、予後に与える影響を検証しました。肺血管拡張薬投与によってCTD-IP-PHの予後は有意に延長し、在宅酸素療法が必要なCTD-IP-PHにおいても、同様の予後改善効果が認めらました。肺血管拡張薬の投与によって、一部の症例の酸素化の悪化など有害事象を認めましたが、多くの場合は休薬や薬剤変更で改善しました。この結果から、たとえ呼吸不全を呈するような重度の肺病変を有する場合も、CTD-IP-PHに対しては積極的な肺血管拡張薬の投与が有益な結果をもたらす可能性が示唆されました。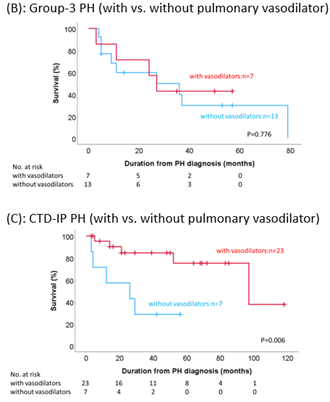
論文実績
- Prognostic analysis of pulmonary hypertension with lung parenchymal lesion: Comparison of mortality with and without connective tissue disease. Yoshifumi Suzuki, Tetsutaro Nagaoka, Yuriko Terayama, Yuichi Nagata, Takashi Yoshida, Takeo Tsutsumi, Sachiko Kuriyama, Masakazu Matsushita, Yusuke Joki, Kiyoshi Takasu, Hakuoh Konishi, Kazuhisa Takahashi. Respiratory Investigation. 2023. In press.
- Periostin-related progression of different types of experimental pulmonary hypertension: A role for M2 macrophage and FGF-2 signalling. Yoshida T, Nagaoka T, Nagata Y, Suzuki Y, Tsutsumi T, Kuriyama S, Watanabe J, Togo S, Takahashi F, Matsushita M, Joki Y, Konishi H, Nunomura S, Izuhara K, Conway SJ, Takahashi K. Respirology. 2022 Mar 22. doi: 10.1111/resp.14249.
- Nintedanib ameliorates experimental pulmonary arterial hypertension via inhibition of endothelial mesenchymal transition and smooth muscle cell proliferation. Tsutsumi T, Nagaoka T, Yoshida T, Wang L, Kuriyama S, Suzuki Y, Nagata Y, Harada N, Kodama Y, Takahashi F, Morio Y, Takahashi K. PLoS One. 2019 Jul 24;14(7):e0214697.
- Potential Role of CT Metrics in Chronic Obstructive Pulmonary Disease with Pulmonary Hypertension. Ando K, Kuraishi H, Nagaoka T, Tsutsumi T, Hoshika Y, Kimura T, Ienaga H, Morio Y, Takahashi K. Lung. 2015 Dec;193(6):911-8.
- Temporal hemodynamic and histological progression in Sugen5416/hypoxia/normoxia-exposed pulmonary arterial hypertensive rats. Toba M, Alzoubi A, O'Neill KD, Gairhe S, Matsumoto Y, Oshima K, Abe K, Oka M, McMurtry IF. Am J Physiol Heart Circ Physiol. 2014 Jan 15;306(2):H243-50
- Genistein attenuates hypoxic pulmonary hypertension via enhanced nitric oxide signaling and the erythropoietin system. Kuriyama S, Morio Y, Toba M, Nagaoka T, Takahashi F, Iwakami S, Seyama K, Takahashi K. Am J Physiol Lung Cell Mol Physiol. 2014 Jun 1;306(11):L996-L1005.
- Involvement of Rho kinase in the pathogenesis of acute pulmonary embolism induced polystyrene microspheres in rats. M. Toba, T. Nagaoka, Y. Morio, K. Sato, K. Uchida, N. Homma, K. Takahashi. Am J Physiol Lung Cell Mol Physiol. 2010 Mar;298(3):L297-303.
- Involvement of RhoA/Rho kinase signaling in protection against monocrotaline-induced pulmonary hypertension in pneumonectomized rats by dehydroepiandrosterone. Homma N, Nagaoka T, Karoor V, Imamura M, Taraseviciene-Stewart L, Walker LA, Fagan KA, McMurtry IF, Oka M. Am J Physiol Lung Cell Mol Physiol. 2008 Jul;295(1):L71-8.
- Endothelin-1 and serotonin are involved in activation of RhoA/Rho kinase signaling in the chronically hypoxic hypertensive rat pulmonary circulation. Homma N, Nagaoka T, Morio Y, Ota H, Gebb SA, Karoor V, McMurtry IF, Oka M. J Cardiovasc Pharmacol. 2007 Dec;50(6):697-702.
- Activity of endothelium-derived hyperpolarizing factor is augmented in monocrotaline-induced pulmonary hypertension of rat lungs. Morio Y, Homma N, Takahashi H, Yamamoto A, Nagaoka T, Sato K, Muramatsu M, Fukuchi Y. J Vasc Res. 2007;44(4):325-35.
- Dehydroepiandrosterone upregulates soluble guanylate cyclase and inhibits hypoxic pulmonary hypertension. Oka M, Karoor V, Homma N, Nagaoka T, Sakao E, Golembeski SM, Limbird J, Imamura M, Gebb SA, Fagan KA, McMurtry IF. Cardiovasc Res. 2007 Jun 1;74(3):377-87.
- Involvement of RhoA/Rho kinase signaling in pulmonary hypertension of the fawn-hooded rat. Nagaoka T, Gebb SA, Karoor V, Homma N, Morris KG, McMurtry IF, Oka M. J Appl Physiol. 2006 Mar;100(3):996-1002.
- Rho guanosine triphosphatases in lung development and pulmonary hypertension. Kaufman J, Sakao E, Oka M, Nagaoka T, Oliver-Picket CK, Jones PL, McMurtry IF, Gebb SA. Chest. 2005 Dec;128(6):610.
- Inhaled Rho kinase inhibitors are potent and selective vasodilators in rat pulmonary hypertension. Nagaoka T, Fagan KA, Gebb SA, Morris KG, Suzuki T, Shimokawa H, McMurtry IF, Oka M. Am J Respir Crit Care Med. 2005 Mar 1;171(5):494-9.
- Rho/Rho kinase signaling mediates increased basal pulmonary vascular tone in chronically hypoxic rats. Nagaoka T, Morio Y, Casanova N, Bauer N, Gebb S, McMurtry I, Oka M. Am J Physiol Lung Cell Mol Physiol. 2004 Oct;287(4):L665-72.
- 間質性肺疾患グループ
-
びまん性肺疾患グループ研究内容
当院において特に重点を置いているびまん性肺疾患領域は、特発性肺線維症を中心とした特発性間質性肺炎、薬剤性肺障害、膠原病関連間質性肺疾患です。1.特発性肺線維症・特発性間質性肺炎
当院では特発性肺線維症の診断に至った症例では積極的な抗線維化薬の導入を行っており、特にNintedanib(オフェブ®) に関しては当科および浦安病院のデータを用いたリアルワールドデータの発表を行っています。 Nintedanibによる消化器関連有害事象はSci Rep誌に [1]、長期使用の有用性についてはATSで発表 (ATS 2020)、Drug Des Devel Ther [2]誌に掲載され、低用量での有用性と安全性についての検討を行いATS (ATS 2021)で発表し論文執筆中です。
また、予後不良である急性増悪の病態に着目し、誘因別の予後の違い、予後予測因子などを後方視的に検討、Respi Res誌に掲載[3] されました。また、急性増悪の際に治療に用いられることがあるPMX-DHPの有効性の指標に関しては国際学会で発表 (ATS 2021)し、現在論文投稿中です。一方、近年着目されているPPFEに関しても当院での症例集積を行っており、PPFE症例の予後因子の解析を行いRespiration誌に掲載[4]されました(浦安病院と共同)。最近は本邦よりPPFEの臨床診断基準案発表されたが発表されたため、当科の症例を用いて各臨床診断基準ごとの予後の調査などを行っております(JRS 2022など)。
当院は厚生労働省びまん性肺疾患研究班の参加施設 であり、他施設との前向き共同研究も積極的に行っています。同研究班で行われた特発性肺線維症に対するピルフェニドン+ムコフィリン吸入併用療法 (研究代表施設:東邦大学)の臨床試験へは8例 (びまん班参加施設内登録患者数3位)の患者登録を行い、本試験の結果についてはEur Respir J誌に掲載[5] されました。やはり当科症例が参加した自己免疫の特徴を有した間質性肺炎(Interstitial pneumonia with autoimmune feature: IPAF)の臨床実態(研究代表施設:浜松医科大学)はThorax誌[6]に、IPFに対する抗線維化薬2剤併用の実態調査 (研究代表施設:自治医科大学)についてはRespir Investig誌[7]で公表されました。また慢性線維化性間質性肺炎の急性増悪の大規模調査(研究代表施設:公立陶生病院)、iPPFE( 特発性胸膜肺実質線維弾性症の elastin 代謝に関連した病態解明とその制御(研究代表施設:東京医科歯科大学)、加湿器肺に関する全国実態調査(研究代表施設:東邦大学)、 間質性肺炎合併肺癌における免疫チェックポイント阻害剤の安全性と有効性を検討する多施設後方視的研究 (研究代表施設:東邦大学)、間質性肺疾患および肺がん患者の苦痛緩和の実態およびQuality of Dying and Death (QODD) に関する研究 : 多施設横断研究(研究代表施設:浜松医科大学)などに当科も参加しています。
最近は前向き試験での症例収集、研究に力を入れています。本邦初の大規模レジストリーである「特発性間質性肺炎に対する多施設共同前向き観察研究(JIPS, 研究代表施設:神奈川県立循環器呼吸器病センター)」には20例 (登録86施設内13位) の症例登録を行い現在は観察期間中です。本試験は付随試験として間質性肺炎の病態に関わる遺伝子検索(NEJ036, 研究代表施設:自治医科大学)も行っており、こちらも現在解析中です。2020年からは、MDD診断やAI診断とも関連した間質性肺疾患の新規レジストリーであるPROMISE試験 (研究代表施設:名古屋大学)、IBiS試験(研究代表施設: 浜松医科大学)にも積極的に症例登録を行っています(2022年5月15日現在73例登録)。
昨今IPFに対しては抗線維化薬の使用頻度が高くなっていますが、膠原病や過敏性肺炎の診断に至らずとも炎症性の素因があるケースなどではステロイドと抗線維化薬の併用療法に期待が持たれます。現在はこれらの併用は一般的ではないため、関東の数施設と共同で、抗線維化薬投与下慢性期特発性肺線維症症例へのステロイド併用実態調査-多施設共同前向き観察試験 (研究代表施設:順天堂大学、2022年5月15日現在、研究全体で27例登録)を行っています。2.薬剤性肺障害
日本人は薬剤に対する肺の脆弱性が指摘されており、薬剤性肺障害の頻度が多いとされています。当グループでは肺癌臨床グループと共同で、抗癌剤における薬剤性肺障害の研究を以前より進めて参りました。Pemetrexedの薬剤性肺障害[8]および進行肺癌患者への抗癌剤投与での薬剤性肺障害におけるSP-Dの有用性 [9]に関しては国際学会で発表を行い、ともにBMC cancer誌に掲載されました。肺癌関連では、免疫チェックポイント阻害薬による肺障害発症について、一例報告をThoracic Cancer 誌では発表[10]し、ILA(Interstitial lung abnormality)に着目して、既存のILAのパターンによる傾向の違いにつて検討し、発表(JRS 2022など)しました。今後は基礎研究でも薬剤性肺障害に着目し、予防の観点からも研究を進めていく予定です。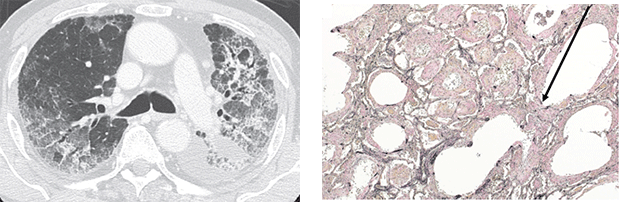 図2:二朮湯投与中にびまん性肺胞障害を生じた1例 (Respirology Case Reports 2016; 4: e00195)
図2:二朮湯投与中にびまん性肺胞障害を生じた1例 (Respirology Case Reports 2016; 4: e00195)3.膠原病関連間質性肺疾患
当院は膠原病の症例が非常に多いため、膠原病に合併した、間質性肺疾患などの呼吸器合併症を有する多くの外来、入院症例を膠原病内科と併診して拝見しています。2019年は抗線維化薬変遷の年となり、今までIPFのみの適応であったNintedanibが全身性強皮症関連間質性肺疾患(SSc-ILD:SCENSCIS試験)、線維化進行性間質性肺炎(PF-ILD;INBUILD)で良好な結果となり、2019年12月よりSSc-ILDにおいて、2020年5月よりPF-ILDに認可され、実際に患者さんへ投与できるようになりました。そのため、当科では膠原病内科と共同で、SSc-ILDおよびPF-ILDでNintedanibを投与する症例を前向きに集め、リアルワールドでのNintedanibの有効性や安全性を検討(SSc-ILDへのニンテダニブ投与の有効性と安全性を確認する前向き観察研究、PF-ILDへのニンテダニブ投与の有効性と安全性を確認する前向き観察研究:ともに研究代表施設:順天堂大学)を行っています。 両試験では並行して、肺高血圧への影響の検討(当科肺循環グループと共同)、Nintedanibの治療効果評価マーカーやSSc-ILDの治療における新規バイオマーカーの探索(当科肺疾患線維化テロメア病態研究グループと共同)、クライオバイオプシーとSSc-ILDやPF-ILDの疾患詳細の診断の有用性、およびNintedanibにおける治療への有用性や有害事象の検討を行っています。そのほか、筋炎関連抗体であるARS抗体陽性症例での検討も行っています。このように多診療科および各研究グループで共同で研究ができるのも、各科や各研究グループ同士の垣根が低い順天堂の強みになります。4.基礎研究
当科では間質性肺炎に関する基礎研究も盛んに行っており、主に肺胞上皮細胞、肺線維芽細胞に着目し研究を行っています。本項では肺胞上皮に関する研究を述べます。肺線維芽細胞に関する研究は肺疾患線維化テロメア病態研究グループの項をご参照ください。
特に肺胞上皮細胞とTGFβ/Smad経路の関連に着目としたメカニズム解析およびBLM肺線維症モデルの構築による薬剤の肺線維化抑制の検討を行っており、DasatinibやTranilastによる肺線維症の抑制効果、Nintedanibのに関して報告 [11、12]に掲載、Nintedanibの上皮間葉転換を標的とした肺線維化抑制効果の確認に関してはRespir Investig誌に掲載 [13]されました。最近は急性増悪の病態にも着目し、そのマウスモデルの構築を行っています。
また、間質性肺炎の気管支肺胞洗浄液の細胞分画の解析を喘息グループと共同で行い、臨床診断病型と気管支肺胞洗浄液の細胞分画の特徴の詳細の検討を行いました。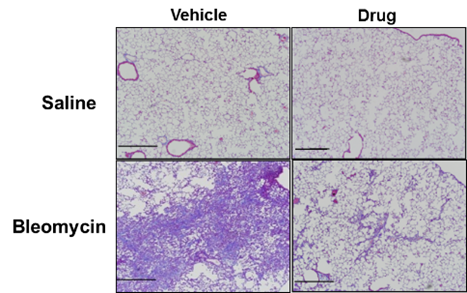 図3. ブレオマイシン肺線維症モデルへの
薬剤投与における線維化抑制効果の確認
図3. ブレオマイシン肺線維症モデルへの
薬剤投与における線維化抑制効果の確認5.若手への教育
当グループでは、豊富な症例数から日本呼吸器学会関東地方会・総会、ATS、ERS、APSRなどの国際学会などで研修医やレジデントの先生を含む若手へ学会発表を提案し、指導しています。2021年のAPSRでは11演題、ATSでは3演題、2022年日本呼吸器学会では8演題を発表しております。その成果として、235回日本呼吸器学会関東地方会では研修医の先生が最優秀賞を獲得、238回、241回、245回、247回では優秀賞を獲得しました。また発表した症例については英文ケースレポートを執筆し各雑誌に掲載されました[14-15]。論文
- Kato M, et al. Gastrointestinal adverse effects of nintedanib and the associated risk factors in patients with idiopathic pulmonary fibrosis. Sci Rep. 2019;9:12062.
- Kato M, et al. Clinical Significance of Continuable Treatment with Nintedanib Over 12 Months for Idiopathic Pulmonary Fibrosis in a Real-World Setting. Drug Des Devel Ther. 2021;15:223-230.
- Kato M, et al. Prognostic differences among patients with idiopathic interstitial pneumonias with acute exacerbation of varying pathogenesis: a retrospective study. Respir Res. 2019;20:287.
- Kato M, et al. Usual Interstitial Pneumonia Pattern in the Lower Lung Lobes as a Prognostic Factor in Idiopathic Pleuroparenchymal Fibroelastosis. Respiration. 2019;97:319-328.
- Sakamoto S, et al. Pirfenidone plus inhaled N-acetylcysteine for idiopathic pulmonary fibrosis: a randomised trial. Eur Respir J. 2021;57:2000348.
- Enomoto N, et al. Prospective nationwide multicentre cohort study of the clinical significance of autoimmune features in idiopathic interstitial pneumonias. Thorax. 2022;77:143-153.
- Hisata S, et al. Safety and tolerability of combination therapy with pirfenidone and nintedanib for idiopathic pulmonary fibrosis: A multicenter retrospective observational study in Japan. Respir Investig. 2021;59:819-826.
- Kato M, et al. Pemetrexed for advanced non-small cell lung cancer patients with interstitial lung disease. BMC Cancer. 2014;14:508.
- Nakamura K, et al. Surfactant protein-D predicts prognosis of interstitial lung disease induced by anticancer agents in advanced lung cancer: a case control study. BMC Cancer. 2017;17:302.
- Kato M, et al. Dramatic, significant metabolic response to a one-time pembrolizumab treatment following a relapse of pre-existing organizing pneumonia in a patient with advanced non-small cell lung cancer: A case report. Thorac Cancer. 2021;12:3076-3079.
- Kanemaru R, et al. Dasatinib Suppresses TGFβ-Mediated Epithelial-Mesenchymal Transition in Alveolar Epithelial Cells and Inhibits Pulmonary Fibrosis. Lung. 2018;196:531-541.
- Kato M, et al. Tranilast Inhibits Pulmonary Fibrosis by Suppressing TGFβ/SMAD2 Pathway. Drug Des Devel Ther. 2020;14:4593-4603.
- Ihara H, et al. Nintedanib inhibits epithelial-mesenchymal transition in A549 alveolar epithelial cells through the regulation of TGF-β/Smad pathway. Respir Investig. 2020;58:275-284.
- Kato Y, et al. Hermansky-Pudlak syndrome-associated pneumothorax with rapid progression of respiratory failure: a case report. BMC Pulm Med. 2020;20:259.
- Ochi Y, et al. Thrombocytopaenia during nintedanib treatment in a patient with idiopathic pulmonary fibrosis. Respir Case Rep, 8, 2020, e00628
- 肺疾患線維化テロメア活性病態研究グループ
-
肺疾患線維化テロメア活性研究グループ
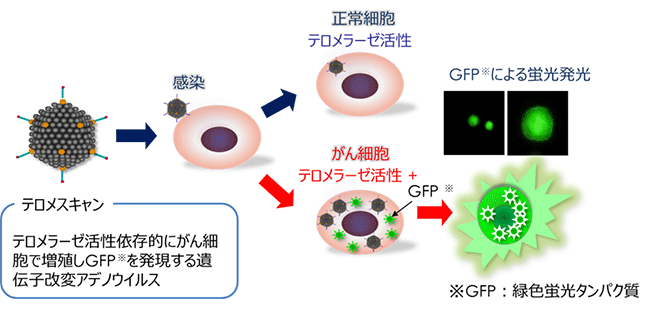
1978年,ノーベル賞生物学者・ブラックバーン博士らのテロメアの同定から、現在、テロメア研究は、不老不死化から若返り研究の焦点になっています。その後,テロメアDNAの修復を行うテロメラーゼ酵素の存在が突き止められました。通常,体細胞はテロメラーゼをもたないため,テロメアは細胞分裂のたびに短くなり、老化とともに縮み細胞増殖できなくなります。これに対して,全てのガン細胞ではテロメラーゼ活性が亢進し、ガン細胞は無限に増殖が可能となります。その特性を利用してテロメラーゼを発現する、生きたがん細胞のみを特異的に感染させ蛍光緑色発色させて検出する遺伝子改変分子標的アデノウイルス(テロメスキャン: Ref 17)を用い、末梢血採血中の血中循環腫瘍細胞(circulating tumor cell; CTC)を超早期肺癌患者から高感度検出を達成しました。これは、いわゆる検診測定の血清CEA値陽性率をはるかに超えるものであり、がん早期診断に向けた検診ドックへの全国普及を目指します。 オンコリスバイオファーマ株式会社が所有する、テロメスキャンによる、この高感度ながん検査技術を,より高精度ながん検診として応用することをビジョンに、呼吸器内科高橋和久教授を講座内教授[兼務]として低侵襲テロメスキャン次世代がん診断学講座を開設しました(写真左)。
CTC検出高感度測定系プラットホームが完成された後には,CTCの表現型解析から個別化医療に向けた取り組みを行っていきます。悪性度が高く、治療抵抗性の上皮間葉転換(EMT)を起こしたEMT-CTC、また、免疫チェックポイント阻害剤奏効予測につながるPD-L1-CTCの定量も可能となりコンパニオン診断化を目標に医師主導前向き臨床試験で現在検証を進めています。CTC測定は、患者様に優しい非侵襲的な採血検査のみで、治療経過の追跡が可能で、全てのがん患者の早期発見・予後改善に向けて、順天堂大学全固形癌種横断的な研究へ展開します(Ref 5, 10, 11, 14)。

リンク
- 順天堂大学とオンコリスバイオファーマ、共同研究講座 「低侵襲テロメスキャン次世代がん診断学講座」を開設|順天堂 (juntendo.ac.jp)
- がん早期・再発診断を目的としたテロメスキャン技術の実用化に向けての 共同研究契約を締結 ~順天堂大学とオンコリスバイオファーマ社~|順天堂 (juntendo.ac.jp)
1889年、Pagetによりseed-and-soil仮説が提唱されました。血中に流れるがん細胞(=CTC)を植物の種seed、臓器を鉢植えsoilに見立て、がんの転移臓器が症例により異なるのは、種がそれに適した土壌にのみ発育するためであるという概念です。我々は、その受け皿となるsoil、すなわち、がん間質研究にも着目しています。肺腺癌は、その昔、瘢痕癌とも呼ばれ、発達した腫瘍内間質が線維化を伴い収縮性変化を起こします。硬いがんは、抗がん剤の移行性が低下し、がん間質の程度はがん悪性度と強く相関します。がん間質の主要な構成細胞であるがん関連線維芽細胞 (Cancer-associated fibroblast: CAF)は、がん細胞とがん間質の相互作用から活性化された筋線維芽細胞様の特性を持ちCAFを介するがん進展・転移の機序を多面的に解明していきます(Ref 4, 9, 20)。従来の研究はがん細胞の遺伝子変異やそのシグナルに着目したがん進展機序の研究が多く、本研究のようにがん間質におけるCAFの遺伝子発現を網羅的に解析し、その機能活性化制御因子を同定した報告はほとんどありません。CAFに対して理化学研究所との共同研究で「CAGE法」を用いた遺伝子発現の網羅的な解析を行い、細胞接着分子のインテグリンα11を介するCAFの活性化機序を解明しました(Ref1)。本成果によりがん間質を標的とした新しい治療法の開発につながることが期待されます。本研究成果は、2021年4月28日記者会見報告(写真左)を通してプレスリリースしました。
リンク
一方でこの活性化した筋線維芽細胞は、線維化の工程で様々な肺疾患の炎症・創傷部位に出現し、細胞外基質の産生と収縮性のストレスファイバーとしてα平滑筋アクチンを産生し、臨床的に様々な肺疾患の病態に深く関与します。収縮能を持つことで、気道腔内の線維化から気道径の狭小化をもたらし、肺機能や肺構造の維持に重大な後遺症を残します。肺線維症(神奈川循環器呼吸器センターとの共同研究: Ref 7, 8)、気管支喘息(Ref 19, 22)、COPD (Ref 13, 15, 21)、嚢胞性疾患(Ref 16)の肺線維芽細胞が、それぞれの肺疾患線維化病態に深く関与し、新たな抗線維化創薬につながる基盤研究を数多く報告し、現在も研究を継続しています。肺線維芽細胞を介する線維化病態、がん間質制御から新たな治療戦略や世界初の画期的がん早期診断法の開発に向けて、幅広く解明する研究チームです。論文
- Cancer-associated fibroblast migration in non-small cell lung cancers is modulated by increased integrin α11 expression. Iwai M, Tulafu M, Togo S, Kawaji H, Kadoya K, Namba Y, Jin J, Watanabe J, Okabe T, Hidayat M, Sumiyoshi I, Itoh M, Koyama Y, Ito Y, Orimo A, Takamochi K, Oh S, Suzuki K, Hayashizaki Y, Yoshida K, Takahashi K. Mol Oncol. 2021 May;15(5):1507-1527.
- High lymphocyte population-related predictive factors for a long-term response in non-small cell lung cancer patients treated with pemetrexed: a retrospective observational study. Sumiyoshi I, Okabe T, Togo S, Takagi H, Motomura H, Ochi Y, Shimada N, Haraguchi M, Shibayama R, Fujimoto Y, Watanabe J, Iwai M, Kadoya K, Iwakami SI, Takahashi K. J Transl Med. 2021 Feb 28;19(1):92.
- Clinical Significance of Continuable Treatment with Nintedanib Over 12 Months for Idiopathic Pulmonary Fibrosis in a Real-World Setting. Kato M, Sasaki S, Tateyama M, Arai Y, Motomura H, Sumiyoshi I, Ochi Y, Watanabe J, Ihara H, Togo S, Takahashi K. Drug Des Devel Ther. 2021 Jan 18;15:223-230.
- Collective cancer cell invasion in contact with fibroblasts through integrin-α5β1/fibronectin interaction in collagen matrix. Miyazaki K, Togo S, Okamoto R, Idiris A, Kumagai H, Miyagi Y. Cancer Sci. 2020 Dec;111(12):4381-4392.
- Mesenchymal Characteristics and Predictive Biomarkers on Circulating Tumor Cells for Therapeutic Strategy. Okabe T, Togo S, Fujimoto Y, Watanabe J, Sumiyoshi I, Orimo A, Takahashi K. Cancers (Basel). 2020 Nov 30;12(12):3588. review
- The synergetic effect of Imipenem-clarithromycin combination in the Mycobacteroides abscessus complex. Takei S, Ihara H, Togo S, Nakamura A, Fujimoto Y, Watanabe J, Kurokawa K, Shibayama K, Sumiyoshi I, Ochi Y, Iwai M, Okabe T, Chonan M, Misawa S, Ohsaka A, Takahashi K. BMC Microbiol. 2020 Oct 19;20(1):316.
- Pirfenidone attenuates lung fibrotic fibroblast responses to transforming growth factor-β1. Jin J, Togo S, Kadoya K, Tulafu M, Namba Y, Iwai M, Watanabe J, Nagahama K, Okabe T, Hidayat M, Kodama Y, Kitamura H, Ogura T, Kitamura N, Ikeo K, Sasaki S, Tominaga S, Takahashi K. Respir Res. 2019 Jun 11;20(1):119.
- Specific Features of Fibrotic Lung Fibroblasts Highly Sensitive to Fibrotic Processes Mediated via TGF-β-ERK5 Interaction. Kadoya K, Togo S, Tulafu M, Namba Y, Iwai M, Watanabe J, Okabe T, Jin J, Kodama Y, Kitamura H, Ogura T, Kitamura N, Ikeo K, Takeda T, Kondo N, Takahashi K.Cell Physiol Biochem. 2019;52(4):822-837.
- Cancer cell migration on elongate protrusions of fibroblasts in collagen matrix. Miyazaki K, Oyanagi J, Hoshino D, Togo S, Kumagai H, Miyagi Y. Sci Rep. 2019 Jan 22;9(1):292.
- Analysis of circulating tumour cell and the epithelial mesenchymal transition (EMT) status during eribulin-based treatment in 22 patients with metastatic breast cancer: a pilot study. Horimoto Y, Tokuda E, Murakami F, Uomori T, Himuro T, Nakai K, Orihata G, Iijima K, Togo S, Shimizu H, Saito M. J Transl Med. 2018 Oct 20;16(1):287.
- Clinical features of squamous cell lung cancer with anaplastic lymphoma kinase (ALK)-rearrangement: a retrospective analysis and review. Watanabe J, Togo S, Sumiyoshi I, Namba Y, Suina K, Mizuno T, Kadoya K, Motomura H, Iwai M, Nagaoka T, Sasaki S, Hayashi T, Uekusa T, Abe K, Urata Y, Sakurai F, Mizuguchi H, Kato S, Takahashi K. Oncotarget. 2018 May 8;9(35):24000-24013.
- Expression of thymidylate synthase predicts clinical outcomes of S-1-based chemotherapy in squamous cell lung cancer. Honma Y, Togo S, Shimizu K, Tulafu M, Hayashi T, Uekusa T, Tominaga S, Kido K, Fujimoto Y, Namba Y, Takamochi K, Oh S, Suzuki K, Takahashi K.Oncol Lett. 2017 Sep;14(3):3319-3326.
- Decrease in an anti-ageing factor, growth differentiation factor 11, in chronic obstructive pulmonary disease. Onodera K, Sugiura H, Yamada M, Koarai A, Fujino N, Yanagisawa S, Tanaka R, Numakura T, Togo S, Sato K, Kyogoku Y, Hashimoto Y, Okazaki T, Tamada T, Kobayashi S, Yanai M, Miura M, Hoshikawa Y, Okada Y, Suzuki S, Ichinose M. Thorax. 2017 Apr 28. pii: thoraxjnl-2016-209352.
- Sensitive detection of viable circulating tumor cells using a novel conditionally telomerase-selective replicating adenovirus in non-small cell lung cancer patients.Togo S, Katagiri N, Namba Y, Tulafu M, Nagahama K, Kadoya K, Takamochi K, Oh S, Suzuki K, Sakurai F, Mizuguchi H, Urata Y, Takahashi K. Oncotarget. 2017 May 23;8(21):34884-34895.
- Combination of glycopyrronium and indacaterol inhibits carbachol-induced ERK5 signal in fibrotic processes. Namba Y, Togo S, Tulafu M, Kadoya K, Nagahama KY, Taka H, Kaga N, Orimo A, Liu X, Takahashi K. Respir Res. 2017 Mar 11;18(1):46.
- Haploinsufficiency of the folliculin gene leads to impaired functions of lung fibroblasts in patients with Birt-Hogg-Dubé syndrome.Hoshika Y, Takahashi F, Togo S, Hashimoto M, Nara T, Kobayashi T, Nurwidya F, Kataoka H, Kurihara M, Kobayashi E, Ebana H, Kikkawa M, Ando K, Nishino K, Hino O, Takahashi K, Seyama K. Physiol Rep. 2016 Nov;4(21). pii: e13025.
- Efficient detection of human circulating tumor cells without significant production of false-positive cells by a novel conditionally replicating adenovirus. Sakurai F, Narii N, Tomita K, Togo S, Takahashi K, Machitani M, Tachibana M, Ouchi M, Katagiri N, Urata Y, Fujiwara T, Mizuguchi H. Mol Ther Methods Clin Dev. 2016 Mar 2;3:16001.
- Variation in the expression levels of predictive chemotherapy biomarkers in histological subtypes of lung adenocarcinoma: an immunohistochemical study of tissue samples. Fujimoto Y, Togo S, Tulafu M, Shimizu K, Hayashi T, Uekusa T, Honma Y, Namba Y, Takamochi K, Oh S, Suzuki K, Takahashi K. Int J Clin Exp Pathol. 2015 Sep 1;8(9):10523-33. eCollection 2015.
- Oncostatin M modulates fibroblast function via signal transducers and activators of transcription proteins-3. Nagahama KY, Togo S, Holz O, Magnussen H, Liu X, Seyama K, Takahashi K, Rennard SI. Am J Respir Cell Mol Biol. 2013 Oct;49(4):582-91.
- Carcinoma-associated fibroblasts are a promising therapeutic target. Togo, S.; Polanska, U.M.; Horimoto, Y.; Orimo, A. Cancers, 2013;5:149-169 review.
- Lung fibroblast repair functions in patients with chronic obstructive pulmonary disease are altered by multiple mechanisms.Togo S, Holz O, Liu X, Sugiura H, Kamio K, Wang X, Kawasaki S, Ahn Y, Fredriksson K, Skold CM, Mueller KC, Branscheid D, Welker L, Watz H, Magnussen H, Rennard SI.Am J Respir Crit Care Med. 2008 Aug 1;178(3):248-60.
- Cultured lung fibroblasts from ovalbumin-challenged "asthmatic" mice differ functionally from normal.Sugiura H, Liu X, Duan F, Kawasaki S, Togo S, Kamio K, Wang XQ, Mao L, Ahn Y, Ertl RF, Bargar TW, Berro A, Casale TB, Rennard SI.Am J Respir Cell Mol Biol. 2007 Oct;37(4):424-30.
- 呼吸管理(睡眠時無呼吸症候群、呼吸不全、呼吸生理)グループ
-
呼吸管理(睡眠時無呼吸症候群、呼吸不全、呼吸生理)グループ研究テーマ
呼吸管理グループは小さな研究グループですが、学内の他学講座や学外施設との共同研究も積極的に行っています。また日々の患者診療に直結する分野であることから、より広く深い専門性を習得することを目的として、外部専門施設へ医局員を派遣し、積極的に学会にも参加し、診療スキルの向上を目指しながらの研究活動を行っています。
閉塞性睡眠時無呼吸症候群に関与する病態として、肥満や骨格に影響による上気道の解剖学的な要因に加えて、上気道開大障害、覚醒閾値の低下、呼吸調節の不安定性(高ループゲイン)が知られています。また体重変化を伴わなくても加齢自体が閉塞性睡眠時無呼吸症候群の重症度を増悪させることも示唆されています。最近の臨床研究では、閉塞性睡眠時無呼吸症候群への長期的な標準治療である経鼻的持続陽圧呼吸が、呼吸調節の不安定性を改善し、閉塞性睡眠時無呼吸症候群の自然経過にプラスの影響を生じ、重症度を軽減し得ることを報告しました。また閉塞性睡眠時無呼吸症候群を代表とする睡眠関連呼吸障害には、閉塞性睡眠時無呼吸症候群以外にも中枢性睡眠時無呼吸症候群や睡眠関連低換気症候群が含まれており、経皮二酸化炭素測定併用の終夜睡眠ポリグラフィー検査や換気応答検査を施行し、ひろく睡眠関連呼吸障害の評価を行っています。他大学との共同研究も継続中です。これまでの臨床研究では、閉塞型睡眠時無呼吸症候群を合併した慢性閉塞性肺疾患患者の終夜ポリソムノグラフィーの特徴の検討、核医学画像解析を用いた閉塞型睡眠時無呼吸症候群の治療前後における脳血流の変化なども研究してきています。これまでの基礎研研究では、睡眠時無呼吸症候群のモデル動物を用いて、睡眠時無呼吸症候群の認知症への影響、心血管系への影響を研究し、論文報告をしています。呼吸管理については、前向き研究としての実施は難しですが、先天性、後天性の様々な呼吸管理を必要とする慢性呼吸不全患者への診療のなかで直面している、呼吸管理の成人移行について、体制の確立を研究テーマとして取り組んでいます。主たる研究成果
- Ai Sugiyama, Satomi Shiota, et. al.The role of long-term Continuous Positive Airway Pressure in the progression of Obstructive Sleep Apnea: A longitudinal cohort study J Sleep Res. 2021
- Naoko Sata, Ayako Inoshita, Shoko Suda, Satomi Shiota, et. al. Clinical, polysomnographic, and cephalometric features of obstructive sleep apnea with AHI over 100. Sleep Breath. 2020
- Motoo Yamauchi, Hideaki Nakayama, Satomi Shiota, et al. Potential patient screening for late-onset Pompe disease in suspected sleep apnea: a rationale and study design for a Prospective Multicenter Observational Cohort Study in Japan (PSSAP-J Study). Sleep Breath. 2020
- Sugiyama AI, Shiota S, et al. Sleep-related breathing disorders associated with the characteristics of underlying congenital rare diseases of Moebius syndrome and Poland syndrome. Respirol Case Rep. 2020
- Yamaguchi Y, Shiota S, et.al. Polysomnographic features of low arousal threshold in overlap syndrome involving obstructive sleep apnea and chronic obstructive pulmonary disease. Sleep Breath. 2019
- Takahashi K, et. al. Chronic intermittent hypoxia-mediated renal sympathetic nerve activation in hypertension and cardiovascular disease. Sci Rep. 2018
- Shiota S, et. al. Effect of continuous positive airway pressure on regional cerebral blood flow during wakefulness in obstructive sleep apnea. Sleep Breath. 2014
- Shiota S, et. al. Chronic intermittent hypoxia/reoxygenation facilitate amyloid-β generation in mice. J Alzheimers Dis. J Alzheimers Dis. 2013
- 感染症グループ
-
感染症グループ
2019年末中国・武漢より発生したSARS-CoV-2による感染症、COVID-19が全世界で猛威を振るっています。日本も例外ではなく、COVID-19による感染が問題となり、感染症分野はこれまでになく注目されている領域となりました。さらに、感染症に対する新規治療薬の開発・ワクチンの開発・感染症の病態の解明など、この分野の研究は無限に広がっています。肺は常に外界と接しており、肺は常に細菌やウイルス、真菌による感染のリスクを持っています。そのため、感染症について研究し、究明していくことは、呼吸器内科の使命の一つと考えています。当グループでは、肺炎におけるサイトカインを中心とした宿主免疫についての研究、非結核性抗酸菌における好中球を中心とした細胞死と感染防御についての研究、Mycobacteroides abscessus感染症での菌の遺伝子解析と臨床データを用いた治療戦略の構築を柱に研究を行っています。さらに、当科の中だけで研究を完結するのではなく、当院臨床検査部、環境医学研究所や東邦大学医学部微生物・感染症学講座、さらには米国ミシガン大学などとの共同研究を行っています。肺炎における生体内のサイトカイン検討
肺炎は日本人の死因の第3位を占める病気です。ヒトの身体は、細菌などの外敵から身を守る道具を持っていて、代表例として、好中球やマクロファージなどがあります。これらは、サイトカインやケモカインといった飛び道具を使って互いに連絡をとっています。しかし、これらのネットワークに関しては、分かっていないことが多いのが現状です。そこで、我々はこれらのネットワークをいろいろな細菌を使用して検証し、明らかにしていこうとしています。さらに、ドラッグレポジショニングといって、現在ある薬剤から、感染症に有効な薬効を見つけ出す検討も行っています。
Yuta Nanjo, Michael W. Newstead, Tetsuji Aoyagi, Xianying Zeng, Kazuhisa Takahashi, Fu Shin Yu, Kazuhiro Tateda, Theodore J. Standiford. Overlapping Roles for Interleukin-36 Cytokines in Protective Host Defense against Murine Legionella pneumophila Pneumonia. Infect Immun. 2019;87: e00583-18
Kajiwara C, Kusaka Y, Kimura S, Yamaguchi T, Nanjo Y, Ishii Y, Udono H, Standiford T and Tateda K. Metformin Mediates Protection against Legionella Pneumonia through Activation of AMPK and Mitochondrial Reactive Oxygen Species. J Immunol 2018; 200: 623-631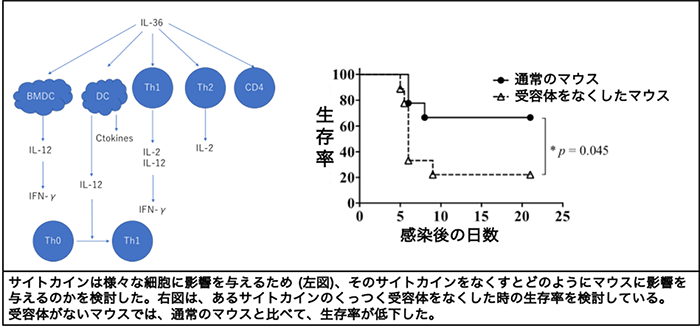
非結核性抗酸菌の感染成立機序の解明
近年、中年女性でこの菌に感染症者が世界的に増加傾向にあり、日本でも同様の傾向を示しています。非結核性抗酸菌症は経過の個人差が大きい病気で、重症になると治療を行ってもゆっくりと進行し、呼吸不全となることもあります。感染時にはマクロファージや好中球、リンパ球を中心に免疫応答がおきます。免疫細胞の細胞死(apoptosis, necroptosis, NETsなど)は感染症を防御することにおいて、重要な役割の一つとされています。そこで我々は好中球の細胞死に着目し、非結核性抗酸菌感染症の経過において好中球の細胞死がどのように影響するのか、防御機構への影響があるのか、肺組織の障害への影響などについて解明に向け研究を行っています。Mycobacteroides abscessus感染症に対する新規治療戦略
肺非結核性抗酸菌症は治療が難しい感染症であり、その中でもMycobacteroides abscessus (M. abscessus) は、日本において3番目に症例数が多く、進行も早いことから新しい治療法の開発が期待されています。M. abscessusは、遺伝子を解析することによって、M. abscessus subsp. abscessus、M. abscessus subsp. massiliense、M. abscessus subsp. bolletiiの3亜種に分類され、抗菌薬の効果に違いがあることが知られています。
順天堂練馬病院で得られた菌株を使用した基礎実験のデータと、患者さんの臨床データとの関連性を調べることで、1)質量分析や遺伝子解析から菌種の早期診断と、2)様々な新規候補薬剤の感受性検査から菌種ごとの最適な治療法の解明を行っています。エンドトキシンショックにおける新規薬剤の作成
細菌の壁にはエンドトキシンという物質があり、ショックの原因の一つです。ポリミキシンはこのエンドトキシンを吸着して不活化させる作用をもっており、集中治療分野では、エンドトキシン敗血症に対してこの薬剤を付着させたカラムを使用した血液灌流療法が行われることがあります。しかし、この製品は非常に高額であるため、より安価で、使用しやすい薬剤を開発しています。そこで、我々は安全性の高い生分解性ポリマーに注目し、この薬剤を付着させ、マウスモデルを用いて徐放製剤の有効性を評価し報告しています。
Nanjo Y, Ishii Y, Kimura S, Fukami T, Mizoguchi M, Suzuki T, Tomono K, Akasaka Y, Ishii T, Takahashi K, Tateda K, Yamaguchi K. Effects of slow-releasing colistin microspheres on endotoxin-induced sepsis. J Infect Chemother. 2013; 19: 683-90.
Hanai Y, Matsuo K, Kosugi T, Kusano A, Ohashi H, Kimura I, Hirayama S, Nanjo Y, Ishii Y, Sato T, Miyazaki T, Nishizawa K, Yoshio T. J Pharm Health Care Sci. 2018 Aug 20;4:22.
学会活動
当教室は、日本内科学会、日本呼吸器学会、日本臨床腫瘍学会、日本がん治療認定医機構、日本呼吸器内視鏡学会、日本アレルギー学会、日本老年医学会の認定教育施設であり、これらの学会に定期的に出席し発表しています。また、学会での学術的活動以外に、日本内科学会認定医、専門医、日本呼吸器学会専門医、同指導医、日本呼吸器内視鏡学会気管支鏡指導医、日本老年医学会専門医、日本臨床腫瘍学会専門医、日本がん治療認定医、日本アレルギー学会専門医、同指導医の取得を励行しています。上記以外の学会としては、日本肺癌学会、日本癌学会、日本免疫学会、日本サルコイドーシス・肉芽腫性疾患学会等へも参加しています。国際学会としてはアメリカ胸部疾患学会(ATS)、ヨーロッパ呼吸器学会(ERS)、アジア太平洋呼吸器学会(APSR)に定期的に参加しており、これら学会会員との学術的交流も盛んに行われています。近年は、日本呼吸器学会で数多くの報告を行っていますが、とくに英語での発表に積極的に取り組んでいます。また、国内、国際学会で発表した研究は、症例報告も含め、原則的に英文論文で発表するように指導しております。
第63回日本呼吸器学会学術講演会 2023年4月28日~30日
第62回日本呼吸器学会学術講演会 2022年4月22日~24日
APSR2021 2021年11月20日~21日
APSR2021
The 25th Congress of the Asian Pacific Society of Respirology
第25回アジア太平洋呼吸器学会学術集会
慎重に協議を重ねた結果、感染拡大防止の観点から2021年11月20日~21日の2日間、国立京都国際会館の現地会場とオンラインとのハイブリッド形式で開催しました。また、12月28日までオンデマンド配信を行っています。
髙橋教授が事務局長を務められ、長岡と原田とが事務局として学会運営を担当させていただきました。おかげ様で盛会となり、過去最多の一般演題応募数(1067演題、Oral:118演題、Poster:949演題)となり、また、過去3番目の参加登録数(2760名)となりました。順天堂大学からもシンポジウム7演題、一般演題54演題(口頭発表4演題、ポスター50演題)、合計61演題を発表しました。Award も15名もの先生が受賞することができました。
このように盛会になりましたことは、皆様方のご協力の賜物と感謝申し上げます。

