- 順天堂大学医学部附属順天堂医院
- 診療科・部門
- 診療科・外来部門
- 膠原病・リウマチ内科
- 医療関係者の⽅へ
- 対象疾患
- 全身性エリテマトーデス
全身性エリテマトーデス
systemic lupus erythematosus, SLE
疾患概念・病態
SLEは原因不明の全身性自己免疫疾患であり、抗核抗体(anti-nuclear antibody, ANA)をはじめとする多彩な自己抗体が出現し、それに関連してループス腎炎をはじめとする多臓器病変が進展する。多くの病態はグルココルチコイドや免疫抑制薬により改善するが、寛解と再燃を繰り返しながら難治性の経過をとる場合もある。極めて多様な臨床像を呈するため、治療は個々の患者における臓器障害の分布や程度によって判断する必要がある。その病態生理も非常に多様であり、遺伝的素因および環境因子が絡み合いながら進展し、多彩な自己抗体の産生とその抗体自体、もしくは抗体と抗原が結合した免疫複合体により多臓器の障害がもたらされるという考えは広く受け入れられている。どのような過程でそれぞれの抗原特異的な免疫応答が誘導されるかは未だ明らかではないものの、T細胞やB細胞の質的および量的な異常による獲得免疫の異常に加え、自然免疫の異常も深く関与していることが示されている。病態の解明は新薬の開発、治療指針の更新につながり、生命予後の改善をもたらしている。
疫学
わが国の特定疾患・指定難病制度から推定されるSLEの有病率は、2021年末での受給者数が64,403人であることから人口10万人当たりの有病率は約51人となる。しかし、2015年に指定難病制度に移行後、軽症患者は新たに認定・更新がされなくなっており、実際にはもう少し多くの患者がいると推測される。20~40歳代の女性に好発し、男女比は1:10とされている。診断・鑑別診断
SLEの診断には1997年に改訂されたアメリカリウマチ学会(American College of Rheumatology, ACR)によって提唱された分類基準(表1)が用いられている。この改定基準では以前の基準で採択されていたLE細胞陽性が削除され、梅毒血清反応偽陽性(biologic false positive, BFP)が抗カルジオリピンIgGまたはIgM抗体、ループス抗凝固因子、およびBFPのいずれかが陽性の抗リン脂質抗体陽性に改変された。しかし、この基準でも臨床所見も血清学的所見もすべての項目が同等に評価され、腎生検でループス腎炎を認めても診断に至らない、血清低補体価などの所見が採択されていない、といった問題点が指摘されていた。この点をふまえ、2012年にsystemic lupus international collaborating clinics(SLICC)がより高い感度を有する改定分類基準を(表2)を提唱した。この基準では臨床的項目と血清学的項目にわけられ、臨床的基準には新たに急性と慢性の皮膚症状および脱毛が加えられ、血清学的基準に血清低補体価やクームス直接試験陽性が加えられた。これらの項目のうち少なくとも血清学的基準の一項目を含む4項目を満たすか、ANAもしくは抗dsDNA抗体陽性で生検によりループス腎炎が組織学的に証明された場合にSLEと診断される。しかしながら、ACR分類と比較し、感度は上昇したが、特異度は低下した。
2019年、新たにACR/EULAR(European Alliance of Associations for Rheumatology;欧州リウマチ学会)の分類基準(表3)が提唱されたが、項目ごとに点数化による重み付けがなされており、感度、特異度ともに高い。
上記いずれを用いてもよいが、あくまでも分類基準であり、診断は、以下の疾患を鑑別・除外できるか確認した上で慎重に行う必要がある。
- シェーグレン症候群(SjS, Sjögren's syndrome)をはじめとする他の膠原病
臓器病変を認めないSLEの軽症例においてはSjSとの鑑別が問題となる。白血球減少および抗SS-A抗体陽性などの所見は両疾患に共通しており、注意を要する。
精神・神経症状に関しては、SLEの精神・神経ループス(neuropsychiatric syndrome of systemic lupus erythermatosus, NPSLE)か、グルココルチコイドの副作用などの除外、血栓性微小血管障害症(thrombotic microangiopathy, TMA)、腎不全などの代謝異常、抗リン脂質抗体症候群(antiphospholipid syndrome, APS)の関与なども確認する。鑑別上、他の病態に関連した病歴の有無、また病態の検索、さらに自己抗体、髄液検査、脳波、SPECT(Single photon emission computed tomography)を含むCTおよびMRI(magnetic resonance imaging)などの画像診断を参考に診断する。 - 薬剤誘発性ループス
ヒドララジン、塩酸プロカインアミドなどの薬剤により薬剤誘発性ループスと呼ばれるSLE様病態が誘発されることがある。抗ヒストン抗体を90%以上に認め、腎症を欠如し、薬剤を中止すると軽快する。 - 感染症
SLEの経過中にも発熱、リンパ節腫脹、漿膜炎、神経症状などが感染に伴い発症することがある。高度なCRPの上昇は感染を疑わせる。
臨床症状
1.初発症状全身症状として発熱、体重減少、リンパ節腫脹などが出現する。
局所症状としては、レイノー現象、紅斑などの皮膚症状、関節痛、さらに浮腫などがみられる。
妊娠・出産や海水浴・登山での紫外線暴露、薬剤などが症状出現のきっかけとなることがある。
2.局所症状(表4)
a.皮膚症状
皮膚症状は最も代表的な初発症状である。
蝶形紅斑、円板状狼瘡、脱毛、レイノー現象、日光過敏、口腔内潰瘍など多彩な病変を認める。レイノー現象では寒冷に暴露すると白色、紫色(チアノーゼ)、発赤と三相性の変化が認められる。脱毛は汎発性もしくは円形状で、手などで毛髪を引くと、多量に抜け落ちる。抜け落ちた毛には毛根を認めない。
b.関節・筋症状
関節痛・関節炎は多発性で手指の近位指節間関節(metacarpophalangeal joint)や中指節間関節(proximal interphalangeal joint)、手、肩、肘および膝関節などに認める。
通常、関節炎は移動性であるが、一定の関節に腫脹を伴う持続性の関節炎として認められることもある。しかし、関節リウマチ(rheumatoid arthritis, RA)のような骨破壊は伴わない。多発性筋炎/皮膚筋炎と同様の筋炎により、近位筋の筋肉痛や脱力感が出現することがある。
c.腎症状
ネフローゼ症候群や腎不全に至るまで浮腫などの自覚症状を認めない。しかし、蛋白尿や赤血球・白血球尿、円柱尿(赤血球、顆粒、硝子、ろう様など)などが早期の病変から出現し、しばしば検診などで偶然に発見されることがある。
一般にSLEでは80%以上の症例に腎病変が認められ、そのうち25~30%が難治性で、10~15%程度が腎不全に移行する。この予後の相違には腎炎の病型が関与し、ISN/RPS(International Society of Nephrology/ Renal Pathology Society)分類のⅢ型やⅣ型の腎炎が難治性の経過をたどることが多い。これに対し、Ⅴ型では80%以上がネフローゼ症候群の状態となるが、抗dsDNA抗体価や血清補体価は正常で、著明な蛋白尿のわりには尿円柱の異常も軽度で腎機能が低下しないとされている。しかし、高度な蛋白尿が10年以上持続すると、Ⅲ型やⅣ型の腎炎と同様に腎機能が低下する。
d.精神・神経症状
初発症状としてはまれであるが、経過中に痙攣重積発作、意識消失発作、脳血管障害、脳神経障害、脊髄障害、無菌性髄膜炎、舞踏病、頭痛、精神症状および末梢神経障害など、多彩な精神・神経症状が出現する。このような神経精神SLE(neuropsychiatric SLE, NPSLE)がACRにより分類されている。
ここでは大きく末梢性と中枢性に分類され、CNS(central nervous system)ループスと呼ばれる中枢性の障害は、無菌性髄膜炎、脳血管障害、脱髄疾患、頭痛、痙攣などの神経症状と、昏迷、神経症、抑鬱および統合失調症様症状などの精神障害などの精神症状に分けられる。acute confusional stateは意識混濁および意識変容をみる意識障害で、anxiety disorderは不安感の精神的表出、不安発作、強迫性障害など、cognitive disfunctionは高次脳機能障害をみる認知障害で、mood
disorderは感情の抑鬱や高揚の持続、さらにpsychosisは幻想や妄想により日常生活に支障をきたす状態で、抗リボゾームP抗体との相関が認められる。
e.心・肺症状
心病変としては心膜炎と心筋炎が認められ、心膜炎は胸膜炎としばしば共存する。これらの病変により、前胸部痛などの自覚症状や心膜摩擦音などの所見を認める。心筋炎は特に抗U1-RNP抗体陽性例での出現率が高い。
肺病変としては胸膜炎に加え、間質性肺炎・肺線維症、ループス肺炎・肺出血、肺梗塞・塞栓などが活動期に出現することがある。
間質性肺炎では息切れ、咳嗽などの自覚症状を認め、乾性ラ音を聴取し、肺梗塞では胸痛、呼吸困難、血痰などを訴える。肺高血圧では聴診でⅡ音の分裂と、肺動脈音の亢進などの所見を聴取する。間質性肺炎および肺高血圧症は抗U1-RNP抗体陽性例で出現率が高くなる。
f.消化器症状
口腔内潰瘍に加え、腹痛・圧痛、筋性防御および腹水などの症状が虚血性腸炎による急性腹症や無菌性腹膜炎において認められる。
炎症性腸疾患に伴う蛋白漏出症候群により下痢症状が出現する。まれに急性膵炎を発症することがあるが、治療に用いられるグルココルチコイドの副作用について留意する必要がある。また、胆嚢はしばしば血管炎の標的臓器となる。
検査所見
1.一般検査a.血液検査所見
検診などで白血球減少が指摘され、本症が発見されることも多い。特 にリンパ球が減少する。また、血小板減少症と自己免疫性溶血性貧血による貧血は重篤で、しばしば治療に抵抗性を示す。抗リン脂質抗体症候群(anti-phospholipid syndrome, APS)でも血小板減少が認められる。また、併発する血栓性微小血管障害症(thrombotic microangiopathy, TMA)や血球貪食症候群(hemophagocytic syndrome, HPS)により汎血球減少症を認めることもある。
b.生化学的検査
ループス腎炎による腎不全にともない血清BUNやクレアチニンが上昇する。ネフローゼ症候群では血清蛋白およびアルブミンの低下、さらに高コレステロール血症が認められる。筋炎では筋原性酵素が上昇するが、多発性筋炎のように著増することはまれである。
肝・胆道系酵素の上昇は経過中80%以上の症例で認められるが、自己免疫性肝炎などはまれであり、薬剤の副作用やウイルス感染などによることが多い。 肺梗塞や肺線維症では血清LDHが上昇する。
c.尿検査所見
尿所見では蛋白尿、細胞性円柱および血尿などの異常所見が認められる。診断のためには一日0.5g以上の蛋白尿、または定量出来ない場合は半定量で3+以上の蛋白尿、もしくは赤血球、顆粒、尿細管上皮などの細胞性円柱を認めるかどうかを確認する必要がある。
2.血清学的所見
高γグロブリン血症に伴う血清膠質反応陽性や、ANAおよびリウマトイド因子(rheumatoid factor, RF)などが検診で指摘されることがある。関節炎や漿膜炎によってCRPが上昇する。血清低補体価も腎症や皮膚病変、さらに溶血性貧血にともなって認められる。
免疫血清学的所見で最も有用な情報を提供するのはANAで、抗dsDNA抗体や抗Sm抗体など、疾患特異抗体以外のANAも病態把握のために有用である。 抗SS-A抗体は、SjSを合併しないSLEでも30~40%に出現し、新生児ループスを有する児の90%以上の母親に検出され、抗リン脂質抗体と同様、妊娠のリスクファクターとなる。抗U1-RNP抗体はレイノー現象などの臨床像に強い相関を示すが、SLEにおいては比較的軽度の腎症を有す群に高率に検出される。抗リボゾームP抗体価はNPSLE、特に精神症状と相関するとされている。
ESRの亢進およびCRPの上昇はSLEにおける炎症性病変に関連して認められる。特に関節炎や漿膜炎などの病態に相関するが、著明な高値をとることはまれで、そのような場合には感染の合併を疑う。
治療
SLEは極めて多様な臨床像を呈するため、個々の患者における臓器障害の分布や程度によって個別に治療方針をたてる必要がある。近年、本邦初のSLE診療ガイドラインが2019年に日本リウマチ学会(JCR)から発行された。またEULARでも診療指針の改定が2023年に発表されている。以下は主にJCRの診療ガイドラインを念頭に解説する。
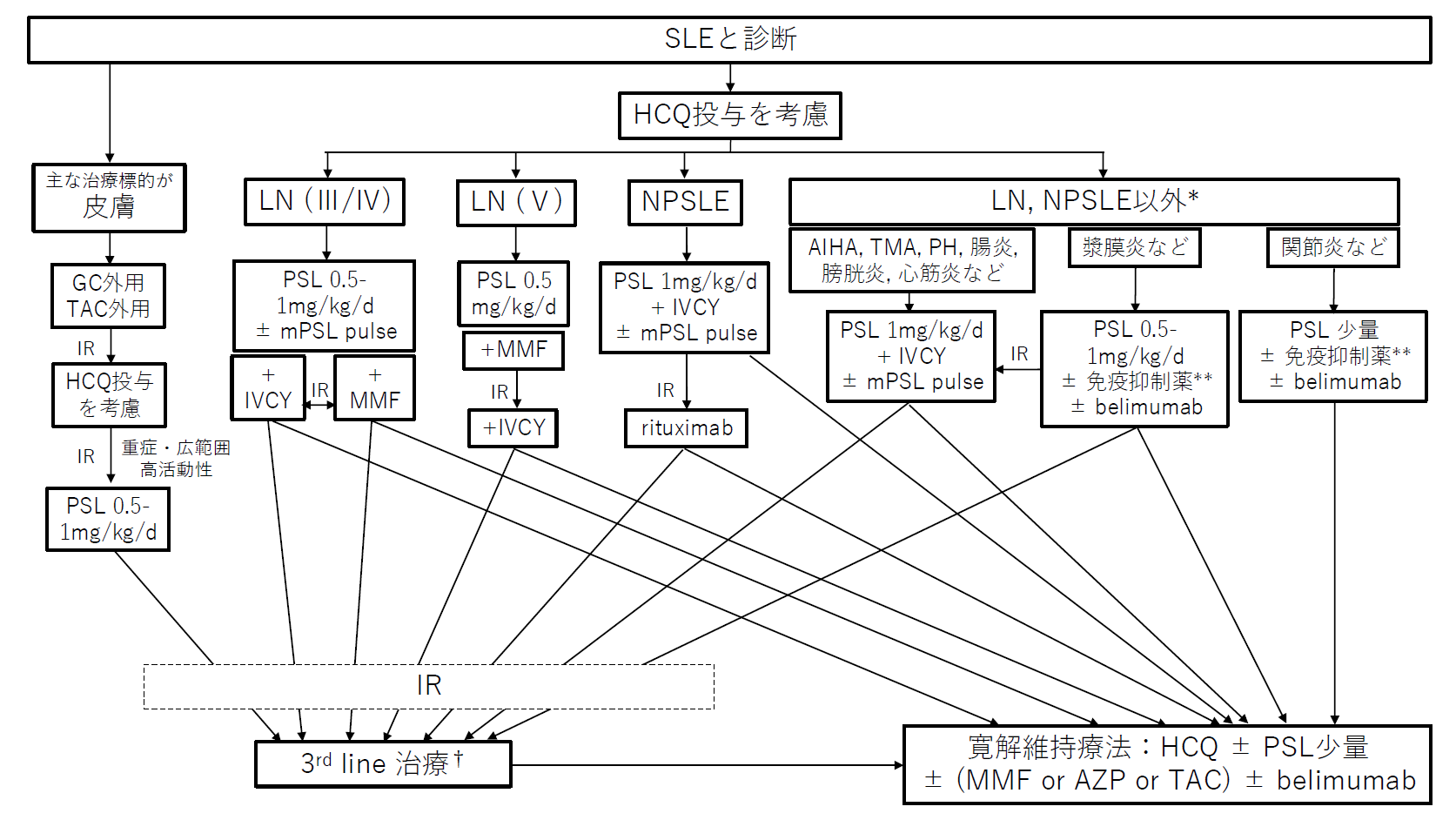
 JCRガイドライン2019より引用改変
JCRガイドライン2019より引用改変- ヒドロキシクロロキン(HCQ)は禁忌がなければ全例投与する。(ただし皮疹のみの場合を除く)
HCQの作用機序について詳細は明らかではないが、Toll様受容体の阻害などを介した多様な免疫調整作用が想定されており、SLEと診断されたすべての患者に投与が推奨されている。 - 臓器障害に対する治療は、どの臓器に、どの程度の障害が生じているかによって治療薬や用量を選択する。以下に主な臓器障害に対する治療を示す。
1)ループス腎炎治療方針の決定や疾患予後の推定のため可能な限り腎生検を行うことが望ましい。その上で組織型に準じて治療方針を決定する。腎生検の施行が困難である場合には、尿所見や血清学的所見などから組織型を類推し、治療方針を決定する。組織型はISN/RPSによる2003年分類に基づいて評価を行う。
AZP:azathioprine(アザチオプリン)ISN/RPS分類 組織学的特徴 臨床所見 治療(寛解導入)Class Ⅰ
微小メサンギウムLN光顕は正常
IFではメサンギウムに免疫沈着物あり尿蛋白陰性 免疫抑制療法は行わない Class Ⅱ
メサンギウム
増殖性LN光顕でメサンギウム細胞増殖もしくはメサンギウムに限局した基質拡大、免疫沈着物あり。
IFまたは電顕で孤立性の上皮下ないし内皮下沈着物がわずかに認められる場合もある。尿蛋白陰性〜軽度
血尿軽度
腎機能は正常免疫抑制療法は行わない Class Ⅲ
巣状LN活動性(A)/非活動性(C)、分節性/全節性、管内性/菅外性の糸球体腎炎で、全糸球体の50%未満(巣状)に病変を認める。 尿蛋白持続陽性
血尿軽度
腎機能の軽度低下(寛解導入療法)
GC 0.5−1.0 mg/kg/日
±mPSL pulse
+MMF/IVCY巣状の内皮下沈着物が見られ、メサンギウム変化は伴う場合と伴わない場合がある。 低補体血症
抗DNA抗体上昇(維持療法)
少量GC + MMF/AZPClass Ⅳ
びまん性LN活動性(A)/非活動性(C)、分節性(S)/全節性(G)、管内性/菅外性の糸球体腎炎で、全糸球体の50%以上(びまん性)に病変を認める。
びまん性の内皮下沈着物が見られ、メサンギウム変化は伴う場合と伴わない場合がある。尿蛋白大量
血尿
細胞性円柱
血清Cre上昇
低補体血症
抗DNA抗体上昇Class Ⅴ
膜性LN光顕/IF/電顕で、全節性/分節性の上皮下免疫沈着物もしくはその形態学的遺残を認める。メサンギウム変化は伴う場合と伴わない場合がある。
Class Ⅲ or Ⅳと複合することがある。尿蛋白大量
血尿軽度
軽度血清補体低下
軽度抗DNA抗体上昇(寛解導入療法)
GC 0.5 kg/kg/日
+MMF±TAC
(維持療法)
少量GC +MMF/AZP+TACClass Ⅵ
硬化性LN糸球体の90%以上が全節性硬化を示し残存腎機能を認めない。 末期腎不全 血液透析
腎移植を考慮
GC:glucocorticoid(グルココルチコイド)…用量はプレドニゾロン換算で表記
IF:immunofluorescence(蛍光抗体法)
IVCY:intravenous cyclophosphamide(シクロホスファミド静注療法)
LN:lupus nephritis(ループス腎炎)
MMF:mycophenolate mofetil(ミコフェノール酸モフェチル)
mPSL:methylprednisolone(メチルプレドニゾロン)
TAC:tacrolimus(タクロリムス)
尚、2023年EUALRのrecommendationsでは、最重症の増殖性糸球体腎炎であってもmPSLパルス療法や種々の免疫抑制薬・生物学的製剤を併用しつつ、後療法のGC用量は0.3〜0.5 mg/kg/日からの開始が推奨されており、他の膠原病と同様にGC総投与量の抑制をはかる動きがある。生物学的製剤のbelimumab(BLM)は寛解導入療法から導入し、維持療法でも他の薬剤と併用することが推奨されている。
また補助療法として腎保護および心血管病の進展抑制目的にアンジオテンシン変換酵素阻害薬(ACEi)/アンジオテンシンⅡ受容体拮抗薬(ARB)を中心とする降圧療法、SGLT2阻害薬(経口血糖降下薬)、脂質異常症治療、抗血栓療法を併用する。
2)神経精神ループス(NPSLE)
病態に応じて、GCや免疫抑制剤、抗血小板・抗凝固療法、抗痙攣薬や抗うつ薬などの対象療法を行う。
寛解導入療法では、高用量GC(1mg/kg/日)+IVCYが推奨されており、mPSLパルスも併用することが多い。既存治療に抵抗性の場合はリツキシマブ(RTX)が提案されている(保険適応外)。
維持療法では、AZPまたはMMFといったB細胞を標的とする治療薬が選択されることが多い。
3)自己免疫性溶血性貧血
高用量GC(1mg/kg/日)を使用する。治療抵抗性の場合には免疫抑制薬(IVCY、AZPなど)を併用するが、薬剤選択は他の臓器合併症を考慮しながら行う。
4)自己免疫性血小板減少
血小板減少の程度は症例により様々だが、血小板数が2万以下になると出血症状を呈することが多く、治療対象となる。GCで治療を行うが高用量を要することも多く、治療抵抗性の場合には特発性血小板減少症に準じて免疫抑制薬の追加や免疫グロブリン静注療法(IVIG)やRTX、トロンボポエチン受容体作動薬の投与や脾摘を行う。
5)血栓性微小血管症(TMA)
血漿交換療法およびmPSLパルスを含む高用量GCで治療を行う。IVCYやRTXを併用することが多い。
6)間質性肺炎
急性の場合にはmPSLパルス+高用量GC(1mg/kg/日)、慢性進行性の場合には0.5−1mg/kg/日のGCを使用する。必要に応じてIVCYやMMF、AZPなどの免疫抑制薬を併用するが確立された治療法はない。
7)心筋炎
高用量GCを使用する。必要に応じてIVCYやMMF、AZPなどの免疫抑制薬を併用するが、カルシニューリン阻害薬については薬剤性の心筋障害に関する報告があり、心筋炎に対する使用については検討を要する。
8)肺高血圧症
膠原病関連肺動脈性肺高血圧症の治療は背景疾患により治療法が異なるが、SLEの場合にはまず免疫抑制薬が主体となり、同時に肺血管拡張薬を併用する。免疫抑制薬については中等量〜高用量GC+IVCYが用いられることが多い。
9)肺胞出血
mPSLパルス療法を行い、IVCYや血漿交換療法の併用が推奨されている。
10)腸炎
中等量〜高用量GCを用いる。腸管からの吸収が高度に低下していると想定される場合には経静脈投与を考慮する。治療抵抗例、重症例、再発例などの場合には免疫抑制薬併用を考慮する。
11)膀胱炎
高用量GCが推奨されている。
12)漿膜炎
中等量〜高用量GC(0.5–1mg/kg)が奏功することが多いが、治療抵抗性の場合にはIVCYなどの免疫抑制薬を併用する。心外膜炎にはコルヒチンを併用することもある。
13)関節炎
非ステロイド系消炎鎮痛薬(NSAIDs)、少量GC、HCQで治療を行う。
治療抵抗性の場合にはメトトレキサート(MTX)を用いる(保険適応外)。
またべリムマブ(BLM)や他の免疫抑制薬(TACなど)を使用することもある。
14)皮疹のみ
皮疹の部位に応じた適切なランクのステロイド外用薬を使用する。
タクロリムス外用薬を使用することもある。
外用薬で効果不十分な場合にはHCQ内服を考慮する。
重症、広範囲、活動性が高い場合にはGC内服を行うが、可能な限り速やかに減量・中止する。
【治療目標】
上記治療の目標は、寛解または低疾患活動性の維持と再燃の阻止である。
2023年EULARのrecommendationでは、GCはプレドニゾロン(PSL) 5 mg/日 以下を目標とし、出来る限り減量、中止も可能としている。しかしながらSLEにおいて完全寛解(GCや免疫抑制薬の使用なしで活動性なく安定)の達成は困難であることが多く、低疾患活動性(LLDAS)またはDORIS(Definition of remission in SLE)の寛解を目標とする。
| LLDASの定義 (Ann Rheum Dis. 2016;75:1615-1621) |
(1)SLEDAI-2K≦4かつ主要臓器系(腎、中枢神経系、心肺、血管炎、発熱)で活動なく、溶血性貧血または腸管の活動性なし
(2)以前の評価と比較して、新しいループス病の活動がない
(3)SELENA-SLEDAI 医師のグローバルアセスメント(スケール0-3)≦1
(4)現在のPSL(相当)≦7.5mg/day
(5)忍容性の高い維持用量の免疫抑制薬と、認可された生物学的製剤の使用可
(2)以前の評価と比較して、新しいループス病の活動がない
(3)SELENA-SLEDAI 医師のグローバルアセスメント(スケール0-3)≦1
(4)現在のPSL(相当)≦7.5mg/day
(5)忍容性の高い維持用量の免疫抑制薬と、認可された生物学的製剤の使用可
| 2021年DORISの寛解の定義 (Lupus Sci Med. 2022;9:e000538) |
- Clinical SLEDAI=0
- 医師のグローバルアセスメント<0.5
※ 血清学的活動性は問わない
※ 抗マラリア薬、PSL 5 mg/日以下のGC、免疫抑制薬・生物学的製剤の使用可
【近年の治療】
2018年に認可されたべリムマブは、上記アルゴリズムで推奨される寛解維持療法のほか、腎炎の寛解導入時など様々な場面で使用されている。
2021年には新たな生物学的製剤としてアニフロルマブが認可された。アニフロルマブは、ヒト抗Ⅰ型インターフェロン(IFN)受容体1モノクローナル抗体で、SLEの病態形成において重要なⅠ型IFNが受容体に結合するのを阻止し、その下流で起こるIFN応答性の遺伝子発現を抑制することで種々の自己免疫応答を抑制すると考えられている。2023年EULAR recommendationでは皮膚や関節症状を主とする症例への投与が推奨されている。
2024年には、新規の経口免疫抑制薬であるボクロスポリンが認可された。カルシニューリンの活性を阻害することによりT細胞の増殖や活性化を抑制する薬剤であり、シクロスポリンやタクロリムスと同系統だが、ボクロスポリンの適応症はループス腎炎に限られる。従来のカルシニューリン阻害薬と比較して、薬物濃度の測定が不要であること、副作用のリスクが低い可能性があることが長所とされている。
その他、多くの生物学的製剤を始めとする分子標的製剤の臨床試験が行われており、今後の導入が期待されている。また血液疾患領域で実用化されているキメラ抗原受容体T細胞療法(chimeric antigen receptor-T cell therapy, CAR-T療法)に関する臨床試験が海外で実施され、SLEなどの膠原病にも有用であるとの報告があり、今後本邦でも治験が開始される見込みである。
予後
1980年以降、SLEの予後は著しく向上し、近年は10年生存率も95%を超えている。これは診断技術の進歩による早期診断、新規治療薬の登場によるが、依然、既存治療に抵抗するいわゆる難治性病態が存在する。一方、治療による副作用も大きな問題で、感染症は死因の第1位となっている。特にGCの副作用は多彩で、心血管病変も含め患者の生活の質(Quality of Life, QOL)をしばしば著しく低下させる。患者にはこれらの一連の副作用を防ぐ目的で治療に対する十分な説明を行い、日常生活指導を適切に行うことが求められる。表1 SLEの分類基準(アメリカリウマチ協会、1997年改訂)
- 頬部紅斑:頬骨隆起部上の紅斑
- 円坂状紅斑
- 光線過敏症:患者病歴または医師の観察による
- 口腔内潰瘍:医師の観察によるもので通常無痛性
- 関節炎:二つ以上の末梢関節の非びらん性関節炎
- 漿膜炎
a.胸膜炎:胸痛、胸膜摩擦音、胸水
b.心膜炎:心電図、心膜摩擦音、心嚢液 - 腎障害
a.0.5g/日以上または3+以上の持続性蛋白尿
b.細胞性円柱:赤血球、顆粒、尿細管性円柱 - 神経障害
a.けいれん
b.精神症状 - 血液学的異常
a.溶血性貧血
b.白血球減少症:4,000/mm3未満が2回以上
c.リンパ球減少症:1,500/mm3未満が2回以上
d.血小板減少症:100,000/mm3未満 - 免疫学的異常
a.抗DNA抗体:二本鎖DNAに対する抗体の異常高値
b.抗Sm抗体の存在
c.抗リン脂質抗体:抗カルジオリピン抗体陽性、ループスアンチコアグラント陽性、梅毒血清反応偽陽性 - 抗核抗体の検出
観察期間中、経時的あるいは同時に11項目中4項目以上存在すればSLEと分類する。
表2 SLICCによる分類基準
臨床的基準
- 急性皮膚型ループス
- 慢性皮膚型ループス
- 口腔潰瘍
- 非瘢痕性脱毛
- 滑膜炎
- 漿膜炎(胸膜炎、心膜炎のいずれか)
- 腎病変(尿蛋白0.5g/日以上、赤血球円柱のいずれか)
- 神経学的病変(痙攣発作、精神病、多発性単神経炎、脊髄炎、末梢・中枢神経障害,急性錯乱状態)
- 溶血性貧血
- 白血球減少(<4,000/mm3、もしくはリンパ球減少(<4,000/mm3)
- 血小板減少(<10万/mm3)
免疫学的基準
- 抗核抗体陽性
- 抗dsDNA抗体陽性(ELISA法では基準値の2倍を超える)
- 抗Sm抗体陽性
- 抗リン脂質抗体陽性
- 低補体(C3、C4、CH50)
- 直接クームス試験陽性(溶血性貧血なし)
上記のうち免疫学的基準1項目以上を含む4項目以上を満たすか,抗核抗体もしくは抗dsDNA抗体が陽性で、生検で証明されたループス腎炎が存在する場合にSLEと分類
表3 ACR/EULAR による分類基準(2019年)
エントリー基準:抗核抗体検査が80倍以上臨床項目
全身症状
発熱(38.3℃以上) 2点
皮膚
非瘢痕性脱毛 2点
口腔潰瘍 2点
亜急性皮膚ループスまたは円板状皮疹 4点
急性皮膚ループス 6点
関節炎
2関節以上の腫脹を伴う滑膜炎 または2関節以上圧痛と30分以上の朝のこわばり 6点
神経
せん妄 2点
精神症状 3点
けいれん 5点
漿膜炎
胸水 または 心嚢水 5点
急性心膜炎 6点
血液
白血球減少 (<4000/μL) 3点
血小板減少 (<10万/μL) 4点
自己免疫性溶血 (直接Coombsテスト陽性かつハプトグロビン低下等の溶血所見) 4点
腎
蛋白尿 0.5g/24hr 4点
Class II or V ループス腎炎 8点
Class III or IV ループス腎炎 10点
免疫学的項目
抗リン脂質抗体
カルジオリピンIgG陽性 またはCLβ2GPI-IgG 陽性 またはLAC陽性 2点
補体
Low C3 または low C4 3点
Low C3 かつLow C4 4点
特異抗体
抗dsDNA抗体 または 抗Sm抗体 6点
臨床項目1項目以上を含む10点以上で分類
表4 SLEの臨床所見の出現頻度(%)
| 皮膚粘膜症状 | 消化器症状 | ||
| 蝶形紅斑 | 73.9 | 肝腫大 | 15.1 |
| 脱毛 | 57.1 | 急性腹症 | 5.0 |
| レイノー現象 | 50.7 | 腹膜炎 | 0.5 |
| 日光過敏症 | 42.9 | ||
| 円板状狼瘡 | 15.3 | リンパ節腫張 | 35.0 |
| 口腔内潰瘍 | 15.0 | ||
| 網状皮斑 | 10.5 | 検査所見 | |
| 赤沈亢進 | 98.3 | ||
| 関節・筋症状 | 溶血性貧血 | 10.3 | |
| 関節痛(炎) | 90.1 | 白血球減少 | 65.5 |
| 無菌性骨壊死 | 10.5 | 血小板減少 | 18.1 |
| 筋肉痛(炎 | 28.1 | 高γグロブリン血症 | 67.5 |
| リウマトイド因子 | 35.8 | ||
| 腎症状 | 直接クームス陽性 | 26.4 | |
| 蛋白尿(3.5g/日未満) | 38.4 | 血清低補体価 | 83.3 |
| 蛋白尿(3.5g/日以上) | 35.7 | 血清梅毒反応偽陽性 | 14.5 |
| 赤血球尿 | 96.9 | 抗核抗体 | 94.3 |
| 細胞性円柱 | 76.9 | 抗DNA抗体 | 89.0 |
| BUN上昇 | 56.9 | 抗Sm抗体 | 23.0 |
| クレアチニン上昇 | 54.7 | 抗U1-RNP抗体 | 38.0 |
| 抗SS-A抗体 | 46.0 | ||
| 精神神経症状 | 抗SS-B抗体 | 9.0 | |
| 精神症状 | 24.1 | 抗Ki抗体 | 18.3 |
| 痙攣発作 | 9.3 | 抗PCNA抗体 | 3.0 |
| 脳波異常 | 38.8 | ||
| CT異常所見 | 44.3 | ||
| 末梢神経障害 | 7.6 | ||
| 心・肺症状 | |||
| 心外膜炎 | 7.5 | ||
| 心筋炎 | 2.2 | ||
| 心電図異常 | 42.8 | ||
| 胸膜炎 | 11.7 | ||
| 間質性肺炎 | 25.6 | ||
| 肺拡散能障害 | 25.5 | ||
| 肺拘束性障害 | 11.7 | ||
| ループス肺臓炎 | 5.8 | ||
| 肺高血圧症 | 1.0 | ||