- 順天堂大学医学部附属順天堂医院
- 診療科・部門
- 診療科・外来部門
- 膠原病・リウマチ内科
- 医療関係者の⽅へ
- 対象疾患
- シェーグレン症候群
シェーグレン症候群
Sjögren's syndrome,SjS
病像の本態は唾液腺や涙腺といった腺組織へのリンパ球浸潤にあるとされている。浸潤細胞は主にCD4+T細胞からなるがCD8+T細胞も存在している。腺組織に浸潤したリンパ球より活性化された上皮細胞は細胞死を増加させ、このアポトーシス細胞表面に発現した抗Ro/SS-A抗体や抗La/SS-B抗体の発現亢進によりさらに自己免疫反応が活性化されることで、腺細胞の破壊がより進行すると考えられている。近年、異常なアポトーシス、サイトカインバランスとToll様受容体(Toll-like receptor:TLR)の活性化、小血管周囲のリンパ球浸潤がシェーグレン症候群の症状発現前に既に局所組織に存在していることが報告されている。病変組織においてB細胞はより進行した病期部位において認められる。全身性に認められる多彩な自己抗体産生とポリクローナルな高ガンマグロブリン血症といったシェーグレン症候群の病態にはB細胞の活性化が関連しているとされ、こういった全身所見を認める場合悪性リンパ腫発現のリスクが高まるとされている。シェーグレン症候群がリンパ増殖性疾患とも称される所以である。
徐々にシェーグレン症候群の組織学的病態の理解はすすんでいるが、腺細胞に対する細胞浸潤や抗Ro/SS-A抗体や抗La/SS-B抗体、リウマトイド因子などの多彩な自己抗体産生が病態形成にどのような役割を担っているのかは未だ完全には解明されていない。発病の誘因としてHLAをはじめとした遺伝的背景に加え、女性ホルモンの関与、ヒトT細胞型白血病ウイルスⅠ型(HTLV-1)やC型肝炎、Epstein-Barrウイルスなどのウイルス感染といった環境要因が考えられている。
先述の通り原発性シェーグレン症候群の発症に遺伝的要素が関わっていると考えられており、シェーグレン症候群が家族内で発症する率は2.2%、他の膠原病が発症する率は8.8%と厚生省(当時)特定疾患難病の疫学調査研究班での全国疫学調査(平成6年)での報告がなされている。
他の自己免疫疾患の一卵性双生児における発症率が高いことからもシェーグレン症候群においてもその一卵性双生児における発病一致率は高いものと推定されている(約25%)が、報告は散発的であり明確な数値は不明である。 報告の人種により差が存在するが、続発性シェーグレン症候群は全身性エリテマトーデスの6.5-19%、関節リウマチの4-31%、強皮症の14-20.5%、原発性胆汁性肝硬変の1.8-35%、甲状腺機能低下症(Grave's病)の1.8-14%に合併するとされている。
海外においては2002年の米国・ヨーロッパ分類(American-European Consensus Group;AECG)基準、2012年に提唱されたアメリカリウマチ学会主導のシェーグレン国際登録ネットワーク診断基準(Sjogren's International Collaborative Clinical Allians;SICCA) が診断に用いられている。シェーグレン症候群との判断をするにあたり、本邦の1999年厚生労働省改訂診断基準と海外における米国・ヨーロッパ分類基準、アメリカリウマチ学会分類基準のいずれの基準を用いるべきか国内10施設において検証が行われたが、感度、特異度ともに1999年厚生労働省改訂診断基準がすぐれているとの報告がなされている。これをもとに指定難病申請におけるシェーグレン症候群の診断基準としても、同基準が採用されている。
乾燥症状については、高齢者では加齢による乾燥症や、抗コリン作動薬(ムスカリン受容体遮断薬)、抗うつ薬などの副作用による乾燥症を鑑別する。また、サルコイドーシス、リンパ腫、ヘモクロマトーシス、アミロイドーシスなど、涙腺、涙液腺組織に炎症を起こす疾患や、頭頸部に放射線照射をうけている患者では乾燥症状を引き起こすことがある。
また、各種自己抗体は合併し得る様々な膠原病などでも陽性となるため、それのみでは鑑別は困難である。特に関節リウマチや全身性エリテマトーデスとの鑑別は、困難な場合も多い。IgG4関連疾患の一型であるMikulicz病も鑑別にあげられる。
尿検査としては尿細管性アシドーシス合併例において尿pHが高くなり、尿中βマイクログロブリンの上昇を認める。
涙腺機能検査、眼科的検索では乾燥性角結膜炎、表層性びらん、角膜潰瘍を認める。涙液分泌の評価試験としてシルマーテストがあり、1mm幅のメモリのついた35mm長のろ紙を下眼瞼耳側に静置し、5分で5mm以下の涙液分泌所見を陽性としている。涙液分泌低下の結果生じる乾燥性角結膜炎の評価染色検査としてはローズベンガルテスト、リサミングリーン、蛍光色素試験がある。細隙灯顕微鏡で眼裂部、下方球結膜の染色を観察する。また、涙液の質の異常を知る検査に涙液層破壊時間(tear film break-up time:BUT)がある。開眼から角膜上の涙液膜が破壊されるまでの時間が5秒以下であればドライアイが疑われる。
唾液腺機能評価としてはガムテスト、サクソンテストがある。ガムテストはガムを10分間噛んで分泌された唾液量を測定する検査である。10ml以下は分泌低下と判定する。サクソンテストはガーゼを口に含んで2分後の重さを測定する検査である。増加が2g以下は分泌低下と判定する。唾液腺造影は造影剤をStenon管より注入し耳下腺を造営する検査である。腺組織の破壊が進むと特徴的なapple tree像を認める。より侵襲の少ない検査としては99mTcO4を用いた唾液腺シンチが行われる。唾液腺シンチでは、軽症例では耳下腺、顎下腺への集積が著明にみられるが高度の唾液腺障害例ではむしろ集積は殆どみられない。ほかにも唾液腺を評価する画像検査として超音波検査やMRIは唾液腺造影検査と同等の診断能があり重症度の評価にも有用である、とシェーグレン症候群ガイドラインでは提案がなされている。口唇小唾液腺の生検は、そのリンパ球浸潤が耳下腺、顎下腺の病理所見に近似するため診断に有用である。
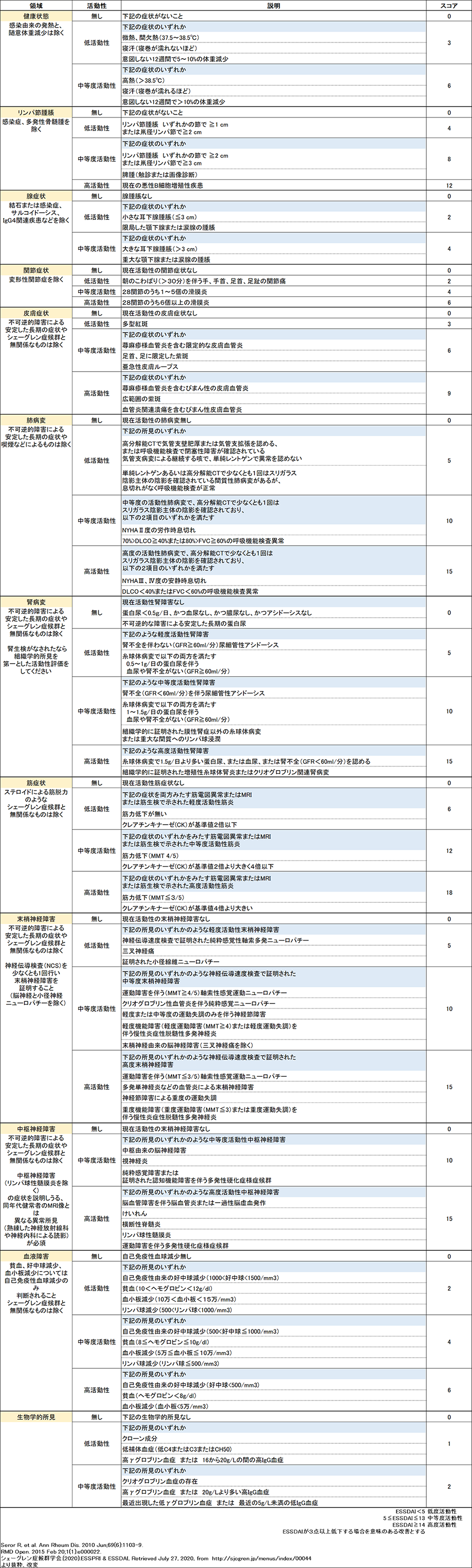
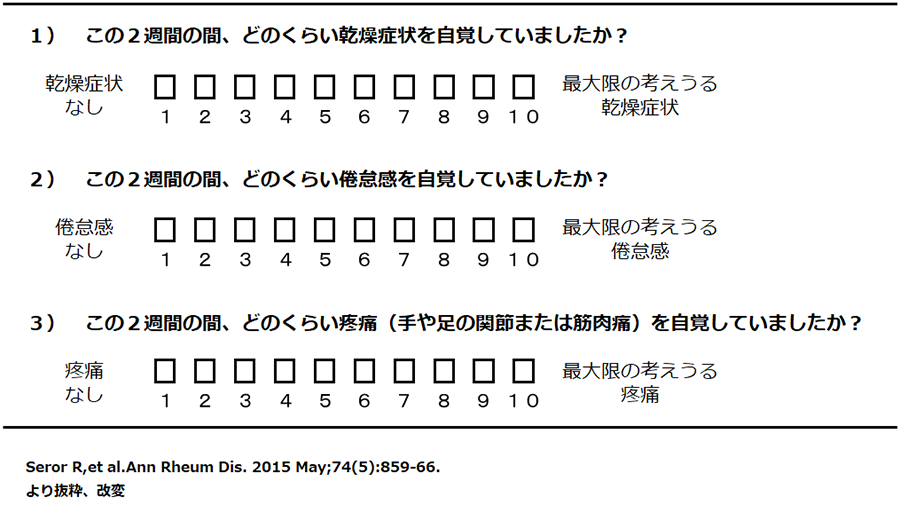
疾患活動性を評価する代表的なツールには、ヨーロッパリウマチ学会(EULAR)が提唱する2つの指標であるEULAR Sjogren's syndrome disease activity index(ESSDAI)とEULAR SS Patient Reported Index (ESSPRI)が挙げられる。ESSDAIは、全般的、リンパ節腫脹、外分泌腺病変、関節症状、皮膚症状、肺病変、腎病変、筋病変、末梢神経病変、中枢神経病変、血液病変、免疫学的変化の12のカテゴリー別に活動性評価を行い、点数を総和して計算する全身状態を評価する手法であり(表2)、ESSPRIは乾燥、倦怠感、疼痛といった自覚症状をスコア化する評価法である(表3)。
シェーグレン症候群に伴うニューロパチーの治療として確立されたものはない。中等度以上のステロイド投与や免疫グロブリン静注大量療法の他、他血漿交換療法、免疫抑制剤、インターフェロンα、D―ペニシラミンが有効だったとの報告がある。 胎児予後に大きな影響を与える先天性完全房室ブロックについては、抗SS-A抗体陽性、抗SS-B抗体陽性妊婦を対象とし胎盤通過性のあるデキサメタゾン投与による胎児房室ブロックの発症予防が検討されたが、予防効果は認めなかったとされている。また、現在のところ経母体的なガンマグロブリン投与による胎児房室ブロックの抑制効果も認められていない。抗SS-A抗体陽性、抗SS-B抗体陽性の母体15名に血漿交換療法を施行して抗体除去による胎児房室ブロックの発症予防を試みた報告では、全例で生児を得て新生児ループスの発症は認めず、14例で抗体価の減少を認めていたものの、抗体価の減少を認めなかった母体から出生した1児で完全房室ブロックの出現を認めていた。
経母体的なデキサメタゾンとβ刺激薬投与の胎児治療としての有効性が報告されているが、房室ブロックの発症率低下自体には関与しないとされている。ステロイドによる抗SS-A抗体および抗SS-B抗体の抗体価の減少、それにより惹起される心筋障害や心内膜線維弾性症の合併を抑制することが期待されるが、経母体的ステロイド薬投与が長期及ぶことで母体の耐糖能異常、胎児の発育遅延や生後の発達遅延などの副作用が懸念される。β刺激薬の母体投与は胎児心拍数を増加させることで胎児心不全や胎児水腫の改善が期待できるがこの治療が児の長期予後を改善するか否かエビデンスに乏しく、こうした治療についてのコンセンサスは現在のところ得られていない。このように、胎児心ブロックについては予防治療、発生後の治療法は確立されておらず、膠原病内科・産科・小児科が連携した上での厳重な管理が求められている。
具体的には齲歯、歯周病の予防のため摂食後の適切な歯磨きを励行すること、乾燥食品、香辛料、過度のアルコール摂取を変えること、喫煙環境を避けること、パソコンなどの機器類使用による眼の酷使を避けること、低湿度環境を避けることなどである。良好な生命予後に反して、乾燥症状の自覚、倦怠感や筋痛、関節痛などの全身症状の存在により生命の質(Quality of Life)は必ずしも良好とはいえない。臓器病変、リンパ腫を合併した場合はそれらにより生命予後も左右される。
以上1、2、3、4のいずれか2項目が陽性であればシェーグレン症候群と診断する。
疾患概念・病態
1933年、スウェーデンの眼科医ヘンリック・シェーグレン博士が乾燥性角結膜炎、耳下腺腫脹、関節炎を呈する患者群を報告したことにちなみ、このような一連の病態はシェーグレン症候群と呼ばれることとなった。主に涙腺、唾液腺といった外分泌腺が標的となることを特徴とする自己免疫疾患の一型であり、リンパ球浸潤による腺組織の障害が腺分泌能の低下、眼と口腔内の乾燥症を来す。多彩な自己抗体や高γグロブリン血症の出現などの免疫学的異常を認め、病態の経過中は涙腺、唾液腺のみならず、全身の臓器や粘膜表面に障害を及ぼし得る。他の自己免疫疾患との合併も多く、関節リウマチ、全身性エリテマトーデス、強皮症、多発性筋炎、皮膚筋炎、混合性結合組織病などと合併する二次性(続発性)シェーグレン症候群と、これらの合併のない一次性(原発性)シェーグレン症候群とに分類される。さらに一次性シェーグレン症候群は病変が涙腺、唾液腺に限局する腺型と、病変が肺・腎臓・膵臓・皮膚・血液・末梢神経など全身臓器に及ぶ腺外型に分けられる。病像の本態は唾液腺や涙腺といった腺組織へのリンパ球浸潤にあるとされている。浸潤細胞は主にCD4+T細胞からなるがCD8+T細胞も存在している。腺組織に浸潤したリンパ球より活性化された上皮細胞は細胞死を増加させ、このアポトーシス細胞表面に発現した抗Ro/SS-A抗体や抗La/SS-B抗体の発現亢進によりさらに自己免疫反応が活性化されることで、腺細胞の破壊がより進行すると考えられている。近年、異常なアポトーシス、サイトカインバランスとToll様受容体(Toll-like receptor:TLR)の活性化、小血管周囲のリンパ球浸潤がシェーグレン症候群の症状発現前に既に局所組織に存在していることが報告されている。病変組織においてB細胞はより進行した病期部位において認められる。全身性に認められる多彩な自己抗体産生とポリクローナルな高ガンマグロブリン血症といったシェーグレン症候群の病態にはB細胞の活性化が関連しているとされ、こういった全身所見を認める場合悪性リンパ腫発現のリスクが高まるとされている。シェーグレン症候群がリンパ増殖性疾患とも称される所以である。
徐々にシェーグレン症候群の組織学的病態の理解はすすんでいるが、腺細胞に対する細胞浸潤や抗Ro/SS-A抗体や抗La/SS-B抗体、リウマトイド因子などの多彩な自己抗体産生が病態形成にどのような役割を担っているのかは未だ完全には解明されていない。発病の誘因としてHLAをはじめとした遺伝的背景に加え、女性ホルモンの関与、ヒトT細胞型白血病ウイルスⅠ型(HTLV-1)やC型肝炎、Epstein-Barrウイルスなどのウイルス感染といった環境要因が考えられている。
疫学
平成23年の厚労省研究班による全国疫学調査では、全国のシェーグレン症候群患者は約7万人と算出されている。また、令和4年度の特定医療費(指定難病)受給者証所持者数は19,290人である。有病率は欧米では白人に多く、成人女性の0.6-4.8%とされており、潜在的な患者数を含めると本邦にも原発性、続発性のシェーグレン症候群を合わせて10~30万人の患者が存在するとも言われている。自己免疫疾患の中でも一次性シェーグレン症候群は特に性差が大きいとされ、その男女比は報告にもよるが1:9~1:20と圧倒的に女性に多い。発症年齢は40-60歳代が多いが小児から高齢者までその幅は広い。先述の通り原発性シェーグレン症候群の発症に遺伝的要素が関わっていると考えられており、シェーグレン症候群が家族内で発症する率は2.2%、他の膠原病が発症する率は8.8%と厚生省(当時)特定疾患難病の疫学調査研究班での全国疫学調査(平成6年)での報告がなされている。
他の自己免疫疾患の一卵性双生児における発症率が高いことからもシェーグレン症候群においてもその一卵性双生児における発病一致率は高いものと推定されている(約25%)が、報告は散発的であり明確な数値は不明である。 報告の人種により差が存在するが、続発性シェーグレン症候群は全身性エリテマトーデスの6.5-19%、関節リウマチの4-31%、強皮症の14-20.5%、原発性胆汁性肝硬変の1.8-35%、甲状腺機能低下症(Grave's病)の1.8-14%に合併するとされている。
診断・鑑別診断
診断は1999年の厚生労働省の改訂診断基準(表1)を用いる。診断基準4項目のうちいずれか2項目が陽性であればシェーグレン症候群と診断する。口唇小唾液腺生検は必ずしも診断に必要ではないが、特に治療方針の決定や病態把握に有用であるとされている。海外においては2002年の米国・ヨーロッパ分類(American-European Consensus Group;AECG)基準、2012年に提唱されたアメリカリウマチ学会主導のシェーグレン国際登録ネットワーク診断基準(Sjogren's International Collaborative Clinical Allians;SICCA) が診断に用いられている。シェーグレン症候群との判断をするにあたり、本邦の1999年厚生労働省改訂診断基準と海外における米国・ヨーロッパ分類基準、アメリカリウマチ学会分類基準のいずれの基準を用いるべきか国内10施設において検証が行われたが、感度、特異度ともに1999年厚生労働省改訂診断基準がすぐれているとの報告がなされている。これをもとに指定難病申請におけるシェーグレン症候群の診断基準としても、同基準が採用されている。
乾燥症状については、高齢者では加齢による乾燥症や、抗コリン作動薬(ムスカリン受容体遮断薬)、抗うつ薬などの副作用による乾燥症を鑑別する。また、サルコイドーシス、リンパ腫、ヘモクロマトーシス、アミロイドーシスなど、涙腺、涙液腺組織に炎症を起こす疾患や、頭頸部に放射線照射をうけている患者では乾燥症状を引き起こすことがある。
また、各種自己抗体は合併し得る様々な膠原病などでも陽性となるため、それのみでは鑑別は困難である。特に関節リウマチや全身性エリテマトーデスとの鑑別は、困難な場合も多い。IgG4関連疾患の一型であるMikulicz病も鑑別にあげられる。
臨床症状
以下のような症状に注意が必要である。- 腺病変
- 乾燥性角結膜炎:約70-90%で出現。眼の異物感、羞明、眼脂などが多い。
- 口腔乾燥症:約75-90%で出現。乾燥物の嚥下困難、発声困難、口腔灼熱感、味覚変化、齲歯の増加など。
- 唾液腺腫脹、耳下腺腫脹、涙腺腫脹:約30%で唾液腺の腫脹を自覚。耳下腺腫脹は両側性無痛性のことが多いが急性の場合には疼痛と腫脹、発熱を伴う。
- その他の乾燥症:約26%で膣乾燥が生じるとの報告もある。また、約55%に皮膚乾燥による掻痒感を認める。
- 腺外病変
- 全身症状:50%ほどに易疲労感が自覚される。10-30%ほどに37度台の発熱を認めるほか、発汗異常も認める。
- 関節炎:移動性、多発性の関節炎を30-60%に認める。抗CCP抗体陽性は低頻度であり、レントゲン上骨びらんを伴わないことが多い。罹患関節数は概ね5箇所未満であるが対称性であることもままあり、早期関節リウマチとの鑑別が難しい場合もある。
- 骨格筋症状:20%ほどに筋痛、筋力低下、筋脱力感などが認められることがある。筋脱力感を認めた場合は間質性腎炎に起因する尿細管性アシドーシスによる低カリウム血症性ミオパチーも考慮すべきである。
- 皮膚症状:約9-20%に環状紅斑を認める。特徴的な所見であり顔面、上肢、背部に好発する。10-15%ほどで高γグロブリン血症に伴う紫斑、下肢の網状皮斑や点状出血を認め、組織学的には白血球破砕性血管炎も所見としてよく見受けられる。凍瘡様皮疹、日光過敏、浸潤性紅斑などもみられることがある。シェーグレン症候群では複数の薬剤に対してアレルギーを起こすことが多く、薬疹が出ることもある。
- 呼吸器症状:約16%になんらかの呼吸器病変が認められる。気道粘膜、気管支腺の委縮による気道の乾燥や気道過敏性などにより、乾性咳嗽、慢性気管支炎、嗄声などがみられることもある。呼吸機能検査では拘束性換気障害、閉塞性換気障害をみとめ、胸部高分解能CTでは気管支拡張症、細気管支拡張症、細気管支異常、すりガラス陰影、間質性変化を認める。間質性肺炎の病理組織学的な分類ではNSIP(nonspecific interstitial pneumonia)パターンが多く(45%)、UIP(usual interstitial pneumonia)パターン(16%)、OP(organizing pneumonia)パターン(7%)も認められる。また、リンパ球様細胞が肺間質、肺胞壁へ著明に浸潤するLIP(lymphoid interstitial pneumonia)パターンも15%程に認められる。
- 消化器症状:胃液の分泌低下による萎縮性胃炎を50%ほどで認める。唾液腺分泌低下による嚥下障害や胸やけなどの逆流性食道炎症状もみられる。胃のMALTリンパ腫の発生頻度も高い。食道蠕動不全が36-90%で認められるとの報告もある。
- 肝障害・膵病変:6-16%に肝障害がみられる。原発性胆汁性肝硬変が5%前後に認められ、原発性胆汁性肝硬変の70%程度にシェーグレン症候群が認められる。自己免疫性肝炎を認めることもある。慢性膵炎は5-20%に合併すると報告されているが、近年IgG4関連疾患としての自己免疫性膵炎はシェーグレン症候群の合併とは異なる病態と考えられている。
- 腎障害:25%ほどで尿所見異常、腎機能障害を認め、15%ほどに腎間質へのリンパ球浸潤による間質性腎炎を認める。5%ほどに遠位尿細管性アシドーシスをきたし、低カリウム血症による四肢脱力を起こすことがある。また約7%に糸球体腎炎を認める。
- 神経障害:約10-20%に末梢神経障害が認められ、感覚失調性ニューロパチー、有痛性感覚性ニューロパチー、多発性短神経戦、三叉神経炎の頻度が高い。中枢神経障害では痙攣、無菌性髄膜炎、多発性脳梗塞、横断性脊髄炎、多発性硬化症類似の症状がみられることがある。また抗アクアポリン4抗体陽性の視神経脊髄炎の合併例(neuromyelitis optica(NMO) spectrum disorder)も報告されている。
- 甲状腺機能障害:抗甲状腺ペルオキシダーゼ抗体、抗マイクロゾーム抗体、抗サイログロブリン抗体といった甲状腺に対する自己抗体の陽性率は約17-36%とされており、慢性甲状腺炎と診断される症例の頻度は約25%である。全身倦怠感の訴えが強い場合は合併を考慮する。
- 血管系:一次性シェーグレン症候群の約30-35%にレイノー現象が観察される。そのような症例では関節炎の合併が多い。血管炎は約5%に認められ、主に中・小血管を侵す。
- 血液疾患:骨髄障害に伴い、約30~60%に貧血、リンパ球優位の白血球減少、約10%に血小板減少を認める。多クローン性の高γグロブリン血症(60~80%)やクリオグロブリン血症(5~10%)も認められる。約30%に全身のリンパ節腫脹を認める。悪性リンパ腫の発生頻度は健常者の44倍、シェーグレン症候群の約5%に発症するという報告もある。好発部位は唾液腺、リンパ節である。主にB細胞リンパ腫であるが、MALT(mucosal-associated lymphoid tissue)リンパ腫の出現も報告されている。悪性リンパ腫合併のリスク因子としては唾液腺腫脹、紫斑の出現、補体C3、C4の低下が挙げられている。
- その他:一次性シェーグレン症候群では自然流産、早産、不当軽量児出産の頻度が有意に高い。一次性シェーグレン症候群の50%、二次性シェーグレン症候群の67%では胎児機能不全のため急速遂娩(帝王切開や鉗子分娩)を必要とするとの報告があり、自己抗体の存在による胎盤の血管炎免疫複合体の沈着による胎盤の組織障害に基づく胎盤機能低下が考えられている。また、母体IgGは胎盤を通じて胎児に移行することから、質量52kDaの抗原と反応する抗SS-A抗体、および抗SS-B抗体は新生児ループス(neonatal lupus erythematosus:NLE)を引き起こす(10-20%)ことと密接に関わると考えられている。NLEではループス様皮疹(顔面、四肢、体幹の輪状紅斑)、白血球減少、血小板減少症などのSLE様の症状などの多彩な臨床像を呈するが、その中の代表的な症状である先天性完全房室ブロックは、胎児に対し恒久的かつ致死的な病態であるため注意が必要である。抗体陽性患者が妊娠した場合、18-24週齢の胎児の約2-5%に完全房室ブロックが生じる可能性がある。胎児心ブロックをスクリーニングする検査法は確立されていない。同一妊婦が先天性完全房室ブロック児を反復出産するリスクは15-18%程度である。妊娠、出産、産褥期において抗SS-A抗体やSS-B抗体価が増悪することは偶発的な場合を除いて無いとされる。
検査所見
血液所見として白血球減少(30-60%)、血小板減少(10%以下)、赤沈亢進、高γグロブリン血症(60-80%)を認めることがある。血小板減少の中には特発性血小板減少性紫斑病の合併する症例もある。クリオグロブリンも5-10%と比較的高率に検出される。抗核抗体は80-90%で陽性となり、染色型は斑紋型(Speckled pattern)が多い。抗SS-A/Ro抗体は一次性シェーグレン症候群の約50-70%、抗SS-B/La抗体は約20-35%に認められる。抗SS-B/La抗体は一次性シェーグレン症候群に特異性が高い。SS-A抗原は主に細胞質に存在し蛋白合成を調節する低分子リボ核蛋白(ribonucleoprotein:RNP)で,4つの低分子hYRNA(hY1、hY2、hY3、hY5) と60kDa または52kDa 蛋白から構成される複合体である。一方SS-B抗原はhYRNA、tRNA 前駆体、プレ5Sr RNA 、プレU6 snRNA、Epstein-Barr virus-encoded small RNAs (EBERs)、adenoviral VA (viral associated) RNAなどの低分子RNA と結合しうる細胞核内の48kDa蛋白で,RNA polymerase Ⅲ の転写を調整する。SS-B抗原はhYRNA を介しSS-A抗原と複合体を形成することが報告されており、SS-B抗原の多くは細胞核内に存在するが、SS-A抗原が存在する細胞質内からも検出される。抗SS-B/La抗体陽性例では、ほぼ抗SS-A/Ro抗体も検出されるが、その理由はこのような両抗原の分布と分子性状によると考えられている。他にもシェーグレン症候群においてリウマトイド因子は約70-80%の症例で陽性となる。また、抗CCP抗体は一次性シェーグレン症候群において5.2-18%で陽性となる。尿検査としては尿細管性アシドーシス合併例において尿pHが高くなり、尿中βマイクログロブリンの上昇を認める。
涙腺機能検査、眼科的検索では乾燥性角結膜炎、表層性びらん、角膜潰瘍を認める。涙液分泌の評価試験としてシルマーテストがあり、1mm幅のメモリのついた35mm長のろ紙を下眼瞼耳側に静置し、5分で5mm以下の涙液分泌所見を陽性としている。涙液分泌低下の結果生じる乾燥性角結膜炎の評価染色検査としてはローズベンガルテスト、リサミングリーン、蛍光色素試験がある。細隙灯顕微鏡で眼裂部、下方球結膜の染色を観察する。また、涙液の質の異常を知る検査に涙液層破壊時間(tear film break-up time:BUT)がある。開眼から角膜上の涙液膜が破壊されるまでの時間が5秒以下であればドライアイが疑われる。
唾液腺機能評価としてはガムテスト、サクソンテストがある。ガムテストはガムを10分間噛んで分泌された唾液量を測定する検査である。10ml以下は分泌低下と判定する。サクソンテストはガーゼを口に含んで2分後の重さを測定する検査である。増加が2g以下は分泌低下と判定する。唾液腺造影は造影剤をStenon管より注入し耳下腺を造営する検査である。腺組織の破壊が進むと特徴的なapple tree像を認める。より侵襲の少ない検査としては99mTcO4を用いた唾液腺シンチが行われる。唾液腺シンチでは、軽症例では耳下腺、顎下腺への集積が著明にみられるが高度の唾液腺障害例ではむしろ集積は殆どみられない。ほかにも唾液腺を評価する画像検査として超音波検査やMRIは唾液腺造影検査と同等の診断能があり重症度の評価にも有用である、とシェーグレン症候群ガイドラインでは提案がなされている。口唇小唾液腺の生検は、そのリンパ球浸潤が耳下腺、顎下腺の病理所見に近似するため診断に有用である。
疾患活動性を評価する代表的なツールには、ヨーロッパリウマチ学会(EULAR)が提唱する2つの指標であるEULAR Sjogren's syndrome disease activity index(ESSDAI)とEULAR SS Patient Reported Index (ESSPRI)が挙げられる。ESSDAIは、全般的、リンパ節腫脹、外分泌腺病変、関節症状、皮膚症状、肺病変、腎病変、筋病変、末梢神経病変、中枢神経病変、血液病変、免疫学的変化の12のカテゴリー別に活動性評価を行い、点数を総和して計算する全身状態を評価する手法であり(表2)、ESSPRIは乾燥、倦怠感、疼痛といった自覚症状をスコア化する評価法である(表3)。
治療
全身症状の有無が治療選択の基準となる。腺症状
ステロイドの全身投与では唾液分泌量、涙液分泌量の改善効果は認められないとされるが、免疫抑制剤であるミゾリビン(ブレディニン®:保険適応外)は唾液量の分泌と乾燥症状の改善が、メトトレキサート(メトレート®など:保険適応外)では乾燥症状の改善が認められると報告されている。1)眼球乾燥
涙液の補充に人工涙液や種々の点眼薬を用いる。点眼液中の防腐剤は点眼後の刺激となる場合があり、重症度に応じて防腐剤非含有点眼剤を使うことが望ましい。角結膜障害の治療としてヒアルロン酸ナトリウム点眼(ヒアレイン®)のほか、ムチン産生促進剤であるジクアホソルナトリウム点眼(ジクアス®)、レバミピド懸濁点眼の使用が推奨されている。 涙の蒸発を防ぐ目的でドライアイ眼鏡(ゴーグル)を使用することもある。重症例では鼻涙管開口部をゴム製プラグで閉じる涙点プラグも、涙液の排出を抑え涙液量、角膜上皮障害を改善するため有効である。 欧米ではシクロスポリン点眼の有効性を示した報告や抗CD20抗体であるリツキシマブ(リツキサン®:保険適応外)の有効性を示した報告もある。またドライマウス治療薬に保険適応となっているセビメリン塩酸塩水和物(エボザック®、サリグレン®)は、ドライアイに対する有効性も報告されている。2)口腔乾燥
ドライマウスに対して飲水やうがいをすることは有効であるが効果時間は短い。人工唾液 (サリベート®)や2%メチルセルロース は乾燥症に対し効果がある。また唾液分泌促進薬として、副交感神経刺激薬(コリン作動薬)の一種でムスカリン性アセチルコリン受容体(M3型)を刺激するセビメリン塩酸塩水和物(エボザック®、サリグレン®)、非選択的ムスカリン受容体刺激薬であるピロカルピン塩酸塩(サラジェン®)がある。口腔乾燥に対する有効性は高く(約60%)シェーグレン症候群診療ガイドライン2017年版でも使用が推奨されている。消化器症状、発汗などの副作用が約30%にみられることに留意し、少量より投与開始し副作用発現を観察するのが望ましい。使用に当たっては重篤な虚血性心疾患、気管支喘息及び慢性閉塞性肺疾患、消化管及び膀胱頸部に閉塞のある患者、てんかん、パーキンソニズム又はパーキンソン病の患者、虹彩炎の患者には使用禁忌であり注意が必要である。塩酸ブロムヘキシジン(ビソルボン®)や漢方の麦門冬湯、人参栄養湯もある程度の効果が認められる。 口腔乾燥は齲歯を来しやすいため、口腔内を清潔に保つよう心がける必要がある。口腔内環境を改善させるために、乾燥食品、香辛料、アルコール飲料の忌避、禁煙が重要である。3)唾液腺の腫脹
熱、リンパ節腫脹とともに反復性の唾液腺の腫脹、疼痛をきたすことがある。短期間ステロイド(プレドニゾロン換算10-20mg)で改善する。また、耳下腺洗浄療法は唾液腺腫脹の改善、再燃抑制効果が期待できるとされている。持続する場合は悪性リンパ腫の存在にも留意する。腺外症状
比較的軽度の全身症状、すなわち発熱、関節痛に対してはまずは非ステロイド性抗炎症薬(NSAIDs)で対処するが、効果不十分の場合は少量ステロイドも考慮する。軽微な症状に対してはプレドニゾロン換算で5-15mg/日を用いることで十分な効果が認められる。また、皮膚病変もステロイドの投与により改善する可能性がある。 進行性の間質性肺炎、糸球体腎炎、自己免疫性肝炎、血管炎性皮膚病変、神経障害、高γグロブリン血症やクリオグロブリン血症にともなう高粘調度症候群、他の活動性の膠原病を合併する場合は中等度以上のステロイド(プレドニゾロン換算で30-60mg/日)や免疫抑制剤のアザチオプリン(アザニン®など:保険適応外)が適応となる場合がある。シクロフォスファミド(エンドキサン®:保険適応外)が肺、腎臓、中枢神経病変を改善する可能性も示されている。合併し得る原発性胆汁性肝硬変の治療はウルソが中心であるが、自己免疫性肝炎の治療ではステロイドが中心となる。シェーグレン症候群に伴うニューロパチーの治療として確立されたものはない。中等度以上のステロイド投与や免疫グロブリン静注大量療法の他、他血漿交換療法、免疫抑制剤、インターフェロンα、D―ペニシラミンが有効だったとの報告がある。 胎児予後に大きな影響を与える先天性完全房室ブロックについては、抗SS-A抗体陽性、抗SS-B抗体陽性妊婦を対象とし胎盤通過性のあるデキサメタゾン投与による胎児房室ブロックの発症予防が検討されたが、予防効果は認めなかったとされている。また、現在のところ経母体的なガンマグロブリン投与による胎児房室ブロックの抑制効果も認められていない。抗SS-A抗体陽性、抗SS-B抗体陽性の母体15名に血漿交換療法を施行して抗体除去による胎児房室ブロックの発症予防を試みた報告では、全例で生児を得て新生児ループスの発症は認めず、14例で抗体価の減少を認めていたものの、抗体価の減少を認めなかった母体から出生した1児で完全房室ブロックの出現を認めていた。
経母体的なデキサメタゾンとβ刺激薬投与の胎児治療としての有効性が報告されているが、房室ブロックの発症率低下自体には関与しないとされている。ステロイドによる抗SS-A抗体および抗SS-B抗体の抗体価の減少、それにより惹起される心筋障害や心内膜線維弾性症の合併を抑制することが期待されるが、経母体的ステロイド薬投与が長期及ぶことで母体の耐糖能異常、胎児の発育遅延や生後の発達遅延などの副作用が懸念される。β刺激薬の母体投与は胎児心拍数を増加させることで胎児心不全や胎児水腫の改善が期待できるがこの治療が児の長期予後を改善するか否かエビデンスに乏しく、こうした治療についてのコンセンサスは現在のところ得られていない。このように、胎児心ブロックについては予防治療、発生後の治療法は確立されておらず、膠原病内科・産科・小児科が連携した上での厳重な管理が求められている。
生物製剤の有効性報告
腺病変だけではなく重症例や続発するB細胞リンパ腫に対して、抗CD20抗体であるリツキシマブ(リツキサン®:保険適応外)が有効であったとの報告や、CTLA4-Igであるアバタセプト(オレンシア®:保険適応外)が有効であったとの報告もある。また、抗BAFF抗体であるベリムマブ(ベンリスタ®:保険適応外)はESSDAI、ESSPRIを改善したが腺機能の改善は無かったと報告されている。一方でインフリキシマブ、エタネルセプトといったTNFα阻害薬については病態改善は乏しいとされている。予後
予後は比較的良好で10~20年後に重症化する頻度は5%ほどと低いとされている。診断確定時の平均年齢およそ49.7歳のシェーグレン症候群患者547名を35年間にわたってフォローした検討では、診断確定時からの平均生存期間は33.7年であり、診断時の腺外病変とりわけ血管炎とリンパ増殖性疾患の存在が予後悪化因子であった。臓器病変を伴わなければ生命予後は悪くないが、臓器病変の合併について定期的な全身検索が必要である。特徴的な腺病変のために口腔環境の悪化、角膜の障害が予想されるため、適切な口腔ケアや点眼を指導する。具体的には齲歯、歯周病の予防のため摂食後の適切な歯磨きを励行すること、乾燥食品、香辛料、過度のアルコール摂取を変えること、喫煙環境を避けること、パソコンなどの機器類使用による眼の酷使を避けること、低湿度環境を避けることなどである。良好な生命予後に反して、乾燥症状の自覚、倦怠感や筋痛、関節痛などの全身症状の存在により生命の質(Quality of Life)は必ずしも良好とはいえない。臓器病変、リンパ腫を合併した場合はそれらにより生命予後も左右される。
表1 シェーグレン症候群 厚生労働省改訂診断基準(1999年)
| 1.生検病理組織検査で次のいずれかの陽性所見を認めること A)口唇腺組織でリンパ球浸潤が 1/4m ㎡当たり 1focus 以上 B)涙腺組織でリンパ球浸潤が 1/4m ㎡当たり 1focus 以上 |
| 2.口腔検査で次のいずれかの陽性所見を認めること A)唾液腺造影で stage I(直径 1mm 以下の小点状陰影)以上の異常所見 B)唾液分泌量低下(ガムテスト 10 分間で 10mL以下,またはサクソンテスト2 分間 2g以下)があり、かつ唾液腺シンチグラフィーにて機能低下の所見 |
| 3.眼科検査で次のいずれかの陽性所見を認めること A)Schirmer 試験で 5mm/5min 以下で、かつローズベンガルテスト(van Bijsterveld スコア)で陽性 B)Schirmer 試験で 5mm/5min 以下で、かつ蛍光色素(フルオレセイン)試験で陽性 |
| 4.血清検査で次のいずれかの陽性所見を認めること A)抗 SS-A/Ro抗体陽性 B)抗 SS-B/La抗体陽性 |
表2 The EULAR Sjögren's syndrome disease activity index (ESSDAI)

表3 The EULAR SS Patient Reported Index (ESSPRI)
