プレスリリース
順天堂医院
順天堂医院主導の医師主導治験により、アテゾリズマブが胸腺癌に対して適応拡大
-日本国内15施設共同研究の成果が希少がん治療の選択肢拡充に貢献-
順天堂大学医学部附属順天堂医院(以下、順天堂医院)が主体となって企画・実施した医師主導治験「カルボプラチン+パクリタキセル+アテゾリズマブ併用療法」第Ⅱ相試験(MARBLE試験、国内15施設共同)の結果に基づき、免疫チェックポイント阻害薬であるアテゾリズマブが胸腺癌に対して新たに保険適用(2025年12月22日)となりました。
順天堂大学は本治験の中核拠点として研究を主導し、治療選択肢が極めて限られている胸腺癌の患者さんに対する新たな治療選択肢の社会実装に貢献しました。
順天堂大学は本治験の中核拠点として研究を主導し、治療選択肢が極めて限られている胸腺癌の患者さんに対する新たな治療選択肢の社会実装に貢献しました。
ポイント
- 順天堂医院主導の医師主導治験(MARBLE試験)を実施した。
- 客観的奏効率56%、無増悪生存期間中央値9.6ヶ月を達成し、これまでの標準治療である、カルボプラチン+パクリタキセルの「癌を縮小させ増殖を抑える効果」を上回り、副作用はコントロール可能な範囲内であった。
- 本結果に基づき、アテゾリズマブの胸腺癌への適応拡大が承認され、希少がんに対するアカデミア主導研究が治療選択肢創出に貢献した。
背景
希少疾患・希少癌は、大規模な臨床試験の実施が困難で、他の癌腫に比べ、治療開発が進まない傾向にあります。胸腺上皮性腫瘍も10万人/年あたり0.15例とまれな腫瘍で、胸腺癌はそのうち14.1%を占める希少疾患となります。一方で、切除不能進行・再発胸腺癌の予後は良好とは言えず、その治療開発には高いアンメットメディカルニーズ*1が存在します。
実際に、本治験の対象である胸腺癌は希少疾患であるが故に、小規模な前向き試験、もしくは後ろ向き試験の報告があるのみとなっています。そのため、新たな治療法の確立は重要な課題であると考えられています。
順天堂医院は本疾患に対する新規治療法開発の必要性に着目し、国内多施設と連携した医師主導治験(MARBLE試験)を企画・実施しました。本研究成果が今回の適応拡大につながり、希少がん医療の前進に寄与しました。
実際に、本治験の対象である胸腺癌は希少疾患であるが故に、小規模な前向き試験、もしくは後ろ向き試験の報告があるのみとなっています。そのため、新たな治療法の確立は重要な課題であると考えられています。
順天堂医院は本疾患に対する新規治療法開発の必要性に着目し、国内多施設と連携した医師主導治験(MARBLE試験)を企画・実施しました。本研究成果が今回の適応拡大につながり、希少がん医療の前進に寄与しました。
内容
アテゾリズマブはPD-L1*2を標的とする免疫チェックポイント阻害薬*3であり、がん細胞による免疫抑制を解除することで抗腫瘍免疫を回復させ、がんの進行を制御する作用を有します。MARBLE試験は、全国15施設が参加する多施設共同の単群第Ⅱ相試験として実施されました。2022年6月14日から2023年7月6日の期間に48人の患者が登録され、以下の治療プロトコールに従い実施されました。
導入療法:カルボプラチン(AUC 6)、パクリタキセル(200 mg/m²)、アテゾリズマブ(1200 mg)を3週間ごとに投与(最大6サイクル)。
維持療法:アテゾリズマブ単剤を3週間ごとに投与(最大2年間)
試験の主要評価項目*4は独立中央判定*5による客観的奏効率(ORR)*6で、副次評価項目として無増悪生存期間(PFS)*7や全生存期間などが含まれました。
主要評価項目であるORRは56%(95%信頼区間: 41–71%)を達成しました。PFSの中央値は9.6ヶ月であり、病勢制御率(DCR)*8は98%でした。有害事象*9については、好中球減少症(56%)や白血球減少症(33%)が最も多く報告されましたが、これらはコントロール可能な範囲内と評価されました。
この結果より、アテゾリズマブは2025年3月31日に切除不能な胸腺癌に対する希少疾病用医薬品の指定を厚生労働省より受け、同年5月14日に承認申請が行われ、12月22日に適応が拡大されるに至りました。
導入療法:カルボプラチン(AUC 6)、パクリタキセル(200 mg/m²)、アテゾリズマブ(1200 mg)を3週間ごとに投与(最大6サイクル)。
維持療法:アテゾリズマブ単剤を3週間ごとに投与(最大2年間)
試験の主要評価項目*4は独立中央判定*5による客観的奏効率(ORR)*6で、副次評価項目として無増悪生存期間(PFS)*7や全生存期間などが含まれました。
主要評価項目であるORRは56%(95%信頼区間: 41–71%)を達成しました。PFSの中央値は9.6ヶ月であり、病勢制御率(DCR)*8は98%でした。有害事象*9については、好中球減少症(56%)や白血球減少症(33%)が最も多く報告されましたが、これらはコントロール可能な範囲内と評価されました。
この結果より、アテゾリズマブは2025年3月31日に切除不能な胸腺癌に対する希少疾病用医薬品の指定を厚生労働省より受け、同年5月14日に承認申請が行われ、12月22日に適応が拡大されるに至りました。
今後の展開
順天堂医院は、厚生労働省が定める臨床研究中核病院(2026年1月21日現在、国内16施設)です。引き続き、革新的医薬品や医療機器の開発の中心的役割を果たすために、質の高い臨床研究や治験を推進して参ります。また、本研究を通じて構築された多施設連携ネットワークを活用し、引き続き、胸腺癌を含む希少がん領域における臨床研究を推進するとともに、実臨床データの収集・解析、そして、腫瘍組織検体や血液検体を用いたトランスレーショナルリサーチ*10を進めることで、より最適な治療戦略の確立を目指します。
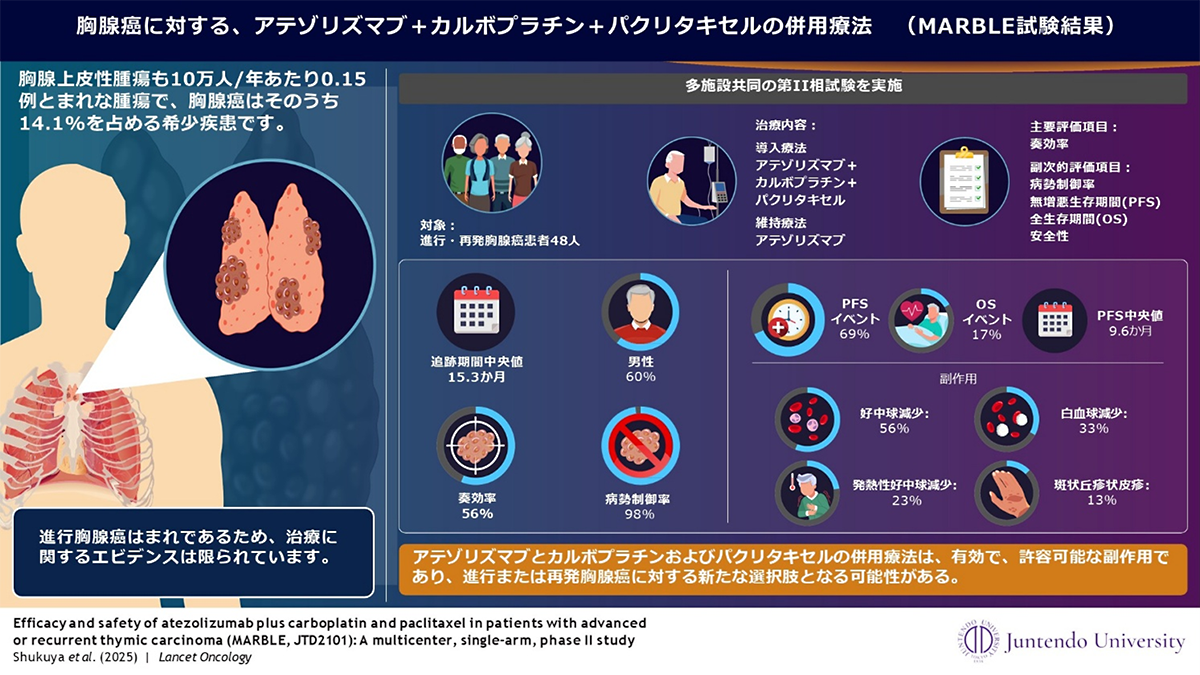 図1:MARBLE試験結果概要
図1:MARBLE試験結果概要
用語解説
*1アンメットメディカルニーズ: いまだに治療法が見つかっていない疾患に対する医療ニーズのこと。具体的には、癌、認知症などの重篤な疾患のほか、不眠症や偏頭痛といった、生命に支障はないものの、QOL改善のために患者から強く求められている疾患に対する医療ニーズを指します。
*2PD-L1(Programmed cell Death 1- Ligand 1): がん細胞などの表面に現れるタンパク質の一つで、免疫の働きにブレーキをかける役割を持つ分子です。PD-L1が働くと、体の免疫細胞ががん細胞を攻撃しにくくなります。そのため、PD-L1は免疫のブレーキとして知られています。
*3免疫チェックポイント阻害薬: 体の免疫には、過剰に働きすぎないようにする「ブレーキ」があります。がんはこのブレーキを悪用して、免疫から攻撃されないようにしています。
免疫チェックポイント阻害薬は、このブレーキを外して、免疫ががんを攻撃しやすくするお薬です。
*4主要評価項目: 臨床試験で最も重要な評価基準のことです。例えば「腫瘍がどれくらい縮小するか」や「病気の進行をどれだけ遅らせるか」など、試験の成功を判断するための基準として設定されます。
*5 独立中央判定: 治療の効果や診断結果を評価する際に、試験に直接関与していない専門家のグループが客観的に判定を行う仕組みです。これにより、公平性や信頼性が高まります。
*6 客観的奏効率(objective response rate;ORR): 患者の治療に対する反応を示す指標で、腫瘍(しゅよう)が小さくなる、または完全になくなる患者の割合を指します。治療の有効性を測るための客観的な基準に基づいて計算されます。
*7無増悪生存期間(Progression Free Survival;PFS): 治療を開始してから病気が悪化せずに安定している期間を指します。この期間が長いほど、治療が病気の進行を抑える効果があると評価されます。
*8 病勢制御率(disease control rate;DCR): 治療後に、腫瘍が縮小または進行が抑えられた患者の割合を示します。「腫瘍が消失または縮小した」「病状が安定している」状態が含まれます。
*9 有害事象: 治療中に発生する、体調や健康状態の望ましくない変化のことです。薬の副作用だけでなく、治療に関連するすべての不調を含みます。重さに応じて評価され、患者の安全を守るための重要な情報です。
*10 トランスレーショナルリサーチ: 研究室で得られた成果を、実際の患者さんの診断や治療に役立てるための研究です。基礎研究と臨床(医療現場)をつなぐ「橋渡し」の役割を担います。